
| 主族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;钙离子的电子式为:Ca2+.
;钙离子的电子式为:Ca2+.分析 (1)同周期从左向右金属性减弱;
(2)S的质子数为16,金属离子的符号为离子的电子式;
(3)非金属性越强,最高价氧化物对应水化物酸性越强;
(4)同周期从左向右原子半径减小;
(5)非金属性越强,对应氢化物的稳定性越强;
(6)Si的氧化物为二氧化硅;
(7)N元素形成的一种氢化物其水溶液呈碱性,氢化物为氨气;
(8)铝和三氧化二铁发生反应生成Fe和氧化铝.
解答 解:(1)同周期从左向右金属性减弱,则第3周期中金属性最强的元素是钠,故答案为:钠;
(2)S的质子数为16,金属离子的符号为离子的电子式,则S原子结构示意图为 ,钙离子的电子式为Ca2+,故答案为:
,钙离子的电子式为Ca2+,故答案为: ;Ca2+;
;Ca2+;
(3)非金属性越强,最高价氧化物对应水化物酸性越强,则第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4,故答案为:HClO4;
(4)同周期从左向右原子半径减小,则C、N和O原子半径由小到大的顺序的是O<N<C,故答案为:O<N<C;
(5)非金属性越强,对应氢化物的稳定性越强,则第3周期中气态氢化物最稳定的是HCl,故答案为:HCl;
(6)Si的氧化物为二氧化硅,化学式为SiO2,故答案为:SiO2;
(7)N元素形成的一种氢化物其水溶液呈碱性,氢化物为氨气,化学式为NH3,故答案为:NH3;
(8)铝和三氧化二铁发生反应生成Fe和氧化铝,反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查位置、结构与性质,为高频考点,把握元素的性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
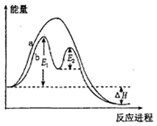
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为吸热反应 | |
| C. | 改变催化剂,可改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
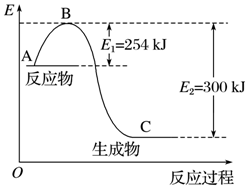 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分的熔点都高 | |
| D. | 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
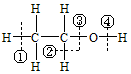 在化学反应中断键位置说法错误的是( )
在化学反应中断键位置说法错误的是( )| A. | 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难电离出氢离子 | |
| B. | 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应 | |
| C. | 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应是取代反应 | |
| D. | 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com