
A、2H2+O2
| ||||
B、NaOH+HCl
| ||||
| C、2CH3OH+3O2═2CO2+4H2O | ||||
| D、Zn+2HCl═ZnCl2+H2↑ |


科目:高中化学 来源: 题型:
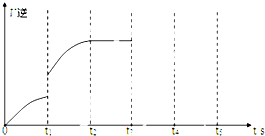 有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.
有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.查看答案和解析>>
科目:高中化学 来源: 题型:
 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )| A、电流从右侧电极经过负载后流向左侧电极 |
| B、A电极上发生氧化反应,B为正极 |
| C、电极A极反应式为2NH3-6e-=N2+6H+ |
| D、当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融电解质中,O2-由正极移向负极 |
| B、电解一共生成0.3mol气体时,转移电子的物质的量为0.2mol |
| C、电解池的阳极反应式为2H2O-4e-═4H++O2↑ |
| D、通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的原子核都是由质子和中子组成的 |
| B、原子的最外层电子数不超过8个 |
| C、稀有气体原子的最外层电子数均为8 |
| D、原子的次外层电子数都是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是有机物中都含有碳元素 |
| B、凡是有机物都易燃烧 |
| C、凡是有机物的水溶液都不导电 |
| D、凡是有机物都只能从有机体中获得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com