
分析 ①Cu位于元素周期表第ⅠB族原子序数为29,根据Cu的电子排布式书写Cu2+离子的电子排布式;
②Cu2O与Cu2S都为离子晶体,离子半径越小,离子键越强,对应的熔点越高.
解答 解:①Cu(电子排布式为:[Ar]3d104s1)Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9,故答案为:[Ar]3d9或1s22s22p63s23p63d9;
②Cu2O与Cu2S都为离子晶体,离子半径越小,离子键越强,对应的熔点越高,因氧离子半径比硫离子半径小,Cu2O比Cu2S的离子键强,所以Cu2O熔点高.
故答案为:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的离子键强,所以Cu2O熔点高.
点评 本题考查常见元素核外电子排布、离子键以及晶格能等知识,为高频考点,题目难度中等,学习中注意加强对核外电子排布的学习.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
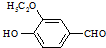 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.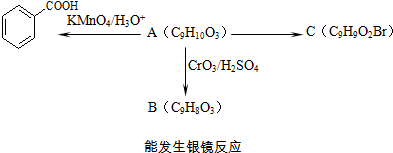
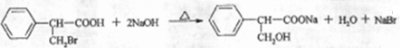
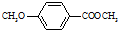 )是一种医药中间体.
)是一种医药中间体. )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤时加入适量石灰石,可减少废气中SO2的含量 | |
| B. | 京津冀、长三角、珠三角雾霾的形成与煤的燃烧、化工厂大量排放含硫、含氮氧化物、颗粒物和汽车排放的尾气等有关 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 使用洁净能源、为汽车安装尾气转化装置、对硝酸厂排放的废气进行碱处理能有效控制氮氧化物对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸应保存在棕色试剂瓶并置于阴凉处 | |
| B. | 氢氟酸不能装在玻璃瓶,应装在塑料瓶中 | |
| C. | NaOH溶液用带磨口玻璃瓶塞的试剂瓶保存 | |
| D. | 常温下浓硫酸和浓硝酸可以铁制槽罐车运输 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于0.9mol | B. | 等于0.9mol | ||
| C. | 在0.45mol与0.9mol之间 | D. | 大于0.9mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com