
【题目】电解原理在化学工业中有广泛的应用。如图所示为一电解池装置,U形管内装有电解液c,A、B是两块电极板,通过导线与直流电源相连。

(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是_____极(填“正”或“负”),B电极是_____极(填“阴”或“阳”);
②A电极产生的气体为________,B电极上的电极反应式为______________;
③检验A电极上产物的方法是:_________________。
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为________。
【答案】正 阴 Cl2 2H2O+2e-===H2↑+2OH- 把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝,则证明A电极上的产物为氯气 1
【解析】
1)①由电流流向可知,和电源的正极相连的电极A极是阳极,和电源的负极相连的电极B极是阴极,该a为;答案:正极,阴极。
②A电极为阳极,溶液中氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,B电极为电解池的阴极,电极上水分子发生得电子的还原反应,即2H2O+2e-=H2↑+2OH-;答案:Cl2 ;2H2O+2e-===H2↑+2OH-。
③检验氯气的方法是把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝,则证明A电极上的产物为氯气;答案:把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝,则证明A电极上的产物为氯气 。
(2)用惰性电极电解CuSO4时,阳极反应式为:2H2O-4e-=4H++O2↑,阴极反应式为:Cu2++2e-=Cu,根据电子守恒可知:n(O2)=1/2n(Cu)=1/2×3.2g/64g![]() mol-1=0.025mol,即标准情况下V(O2)=0.56L,根据2CuSO4+2H2O
mol-1=0.025mol,即标准情况下V(O2)=0.56L,根据2CuSO4+2H2O![]() 2Cu↓+O2↑+2H2SO4,可知,电解后溶液中n(H+)=4n(O2)=0.1mol,所以c(H+)=0.1mol/L,pH=1。
2Cu↓+O2↑+2H2SO4,可知,电解后溶液中n(H+)=4n(O2)=0.1mol,所以c(H+)=0.1mol/L,pH=1。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的盐酸溶液,实验如下:用1.00 mL待测盐酸配制100 mL稀盐酸,以0.10 mol/L的NaOH溶液滴定25.00 mL上述稀盐酸,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______(填“偏大”、“偏小”或“无影响”,下同);若观察碱式滴定管读数时,滴定前仰视而滴定后俯视,则结果会导致测得的稀盐酸溶液浓度值_________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的________(选填“甲”或“乙”);下图在滴定操作时,排去碱式滴定管中气泡的方法应采用操作______(选填“甲”、“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)配制100 mL一定浓度的稀盐酸溶液,除使用量筒、烧杯、玻璃棒、和胶头滴管外还需用到的仪器是______________,计算待测盐酸(稀释前的盐酸)溶液的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
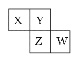
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子是检验Fe3+的常用试剂,X、Y形成的化合物YX3,常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是
A. 原子半径:Z>Y>W>X
B. YX3属于离子化合物
C. Y、Z形成的化合物中只含有离子键
D. Z的氧化物对应的水化物属于强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
滤渣的成分是________,反应②的离子方程式是________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ge(OH)4的数据如下表:
干法空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 110120 | 90 | 18 |
在对流空气氧化炉中 | 110120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
(3)利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3 (如图):阳极电极反应式为______,离子交换膜为______ (填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B. 以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
D. 钢铁发生吸氧腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是( )
A. HB—水解方程式:HB-+H2O![]() H3O++B2- B. 相同物质的量浓度溶液的pH值:NaHB > Na2B
H3O++B2- B. 相同物质的量浓度溶液的pH值:NaHB > Na2B
C. NaHB的存在抑制了水的电离 D. 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)漂白粉的有效成分是_____。
(2)高炉炼铁中存在反应:3CO+Fe2O3![]() 3CO2+2Fe,该反应中氧化剂是_____。
3CO2+2Fe,该反应中氧化剂是_____。
(3)1.2g RSO4中含0.01molR2+,则RSO4的摩尔质量是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com