
分析 (1)在该反应中锰从+7价降为+2价,氯从-1价升为0价,根据化合价升降法可结构观察法可配平;
(2)在氧化还原反应中,有元素化合价降低的物质为氧化剂,元素化合价升高后得到的产物为氧化产物;
(3)根据化学方程式计算消耗的HCl,根据氧化还原反应的有关概念可知,被氧化的HCl即化合价升高的部分HCl,据此进行计算.
解答 解:(1)在该反应中锰从+7价降为+2价,氯从-1价升为0价,在氧化还原反应元素化合价升高的总数与降低的总数应相等,结合质量守恒可知,该反应的方程式为2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O,
故答案为:2、16、2、2、5、8;
(2)在反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,KMnO4中锰元素化合价从+7价降为+2价,所以KMnO4是氧化剂,盐酸中的氯元素化合价升高后得到的产物Cl2,所以Cl2为氧化产物,
故答案为:KMnO4;Cl2;
(3)71g Cl2即1molCl2,根据化学方程式2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O可知,生成1molCl2消耗的HCl3.2mol,其中有2molHCl被氧化成氯气,
故答案为:3.2;2.
点评 本题考查学生氧化还原反应中的有关概念和计算,要求学生要熟练掌握基础知识,并具有一定分析和解决问题的能力,难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
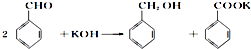
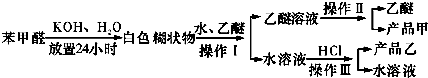
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.
实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2NaOH+H2↑.
=2NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
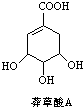 为原料的有机合成路线:
为原料的有机合成路线:
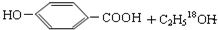 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$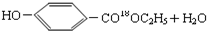 .
.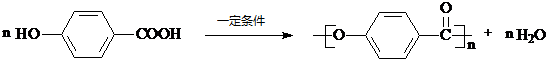 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com