
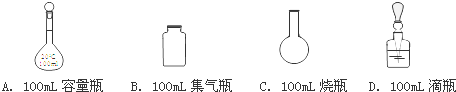
分析 (1)根据配制100mL1mol/L的稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,需要使用的仪器有:①烧杯 ③量筒 ⑤100mL容量瓶 ⑦玻璃棒,据此分析;
(2)配制时两次用到玻璃棒,一次是浓硫酸稀释,需要用玻璃棒搅拌,散热防止液滴飞溅,二次是转移溶液至容量瓶,作用为引流,防止液体外流损失;(3)根据过程:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签可得答案;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)根据配制100mL1mol/L的稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,需要使用的仪器有:①烧杯 ③量筒 ⑤100mL容量瓶 ⑦玻璃棒,
故答案为:A;
(2)配制时两次用到玻璃棒,一次是浓硫酸稀释,需要用玻璃棒搅拌,散热防止液滴飞溅,二次是转移溶液至容量瓶,作用为引流,防止液体外流损失,故答案为:搅拌;转移液体;
(3)根据过程:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签的操作步骤,用一定规格的量筒准确量取所需浓硫酸的体积,缓缓注入水中,用玻璃棒慢慢搅动,使其充分溶解,将已冷却的溶液沿玻璃棒注入100mL的容量瓶中,用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,继续往容量瓶内小心加水,直到液面接近刻度1~2cm处,改用胶头滴管加水,使溶液凹面恰好与刻度相切,将容量瓶盖紧,摇匀,
故答案为:B、C、A、F、E、D;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(3)①没有洗涤烧杯或玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,
①没有洗涤烧杯和玻璃棒,造成硫酸溶质损失,浓度偏低;
②如果加水超过了刻度线,取出水使液面恰好到刻度线,相当于溶质减少,浓度偏低;
③溶液转移到容量瓶之后还得加蒸馏水,故容量瓶没有干燥无影响;
④定容时仰视刻度线,体积读大,水加多了,浓度偏低;
故答案为:①②④.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题为中等难度试题,试题基础性强,难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练;该题的难点在于误差分析,注意明确误差分析的方法.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
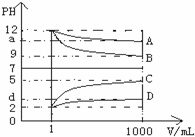
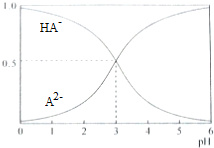 室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )
室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )| A. | H2A的电离方程式为H2A?H+HA- | |
| B. | 将pH=2的NaHA和Na2A混合溶液中加水稀释10倍,溶液的pH=3 | |
| C. | 将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液的pH一定为3 | |
| D. | Na2A溶液存在:c(0H-)=c(H+)+c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
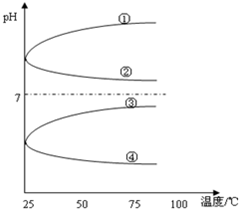 A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com