
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+ . 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.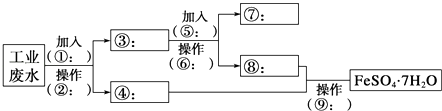
(1)操作②的名称为 , 所需要的玻璃仪器为、、烧杯.
(2)试剂⑤的化学式为 , 发生的化学方程式为 .
(3)为验证溶液⑧中含有SO42﹣:取少量的溶液⑧于试管中,先加入再加入 , 若观察到有白色沉淀,则说明溶液⑧中含有SO42﹣ .
【答案】
(1)过滤,漏斗,玻璃棒
(2)H2SO4,Fe+H2SO4=FeSO4+H2↑
(3)足量稀盐酸,少量BaCl2溶液
【解析】解:工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,①为Fe,操作②为过滤,则E中主要含硫酸亚铁,③中含Cu、Fe,加入⑤为H2SO4,操作⑥为过滤,得到⑦为Cu,⑧中主要含FeSO4,操作⑨为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
(1)操作②的名称为过滤,所需要的玻璃仪器为漏斗、玻璃棒、烧杯;
(2)试剂⑤的化学式为H2SO4,化学方程式为Fe+H2SO4=FeSO4+H2↑;
(3)先加入足量稀盐酸再加入少量BaCl2溶液,若观察到有白色沉淀,则说明溶液⑧中含有SO42﹣;
所以答案是:(1)过滤;漏斗;玻璃棒;(2)H2SO4;Fe+H2SO4=FeSO4+H2↑;(3)足量稀盐酸;少量BaCl2溶液.


科目:高中化学 来源: 题型:
【题目】有关下列图象的分析正确的是( ) 
A.图①表示在N2(g)+3H2(g)2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)+I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C.图③说明HB是比HA更弱的酸
D.图④中的y表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,所含分子数最少的是( )
A. 0.8mol CO2
B. 标准状况下,11.2L NH3
C. 3.6g H2O
D. 6.02 ×1023个氯气分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在酸性条件下,CH3CO18 OC2H5的水解产物是CH3CO18OH和C2H5OH
B.乙醛和丙烯醛不是同系物,它们与H2充分反应后的产物是同系物
C.用溴水可以鉴别苯酚溶液、2,4﹣己二烯、甲苯和CCl4
D.乳酸薄荷醇酯(  )能发生水解反应、氧化反应、消去反应、取代反应
)能发生水解反应、氧化反应、消去反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )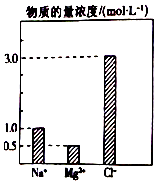
A.NaCl的物质的量为0.2mol
B.溶质MgCl2的质量为9 g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1 L,稀释后溶液中的Ba2+物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作正确的是
A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒
C.经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等
D.用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图: 
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: .
(2)A、B、H的化学式:A、B、H .
(3)①H2O2分子的电子式: . ②写出D→F的离子方程式: .
(4)写出鉴定E中阳离子的实验方法和现象: .
(5)在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com