
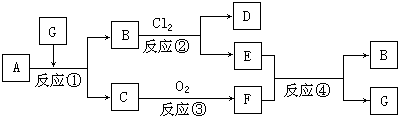
分析 C、F是常温下无色气体,而且根据题意C燃烧生成F,可见C是可燃性气体;D、E具有共同的阳离子,可见B中的阴离子不是Cl-,G则可能是稀硫酸且B中阳离子与D、E中阳离子都属于同一种有变价的金属元素,故为Fe,结合转化关系可知,A为FeS,G为H2SO4,B为FeSO4,C为H2S,D为FeCl3,E为Fe2(SO4)3,F为SO2 .
解答 解:C、F是常温下无色气体,而且根据题意C燃烧生成F,可见C是可燃性气体;D、E具有共同的阳离子,可见B中的阴离子不是Cl-,G则可能是稀硫酸且B中阳离子与D、E中阳离子都属于同一种有变价的金属元素,故为Fe,结合转化关系可知,A为FeS,G为H2SO4,B为FeSO4,C为H2S,D为FeCl3,E为Fe2(SO4)3,F为SO2 .
(1)由上述分析可知,B和C的化学式分别为:FeSO4、H2S,
故答案为:FeSO4;H2S;
(2)反应①的离子方程式为:FeS+2H+=H2S↑+Fe2+,
反应②的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
反应④的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:FeS+2H+=H2S↑+Fe2+;2Fe2++Cl2=2Fe3++2Cl-;2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查无机物推断,基本属于猜测验证型题目,需要学生熟练掌握元素化合物知识,注意充分挖掘题目中的信息,难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| 物质 | NaF | NaI | MgO |
| 离子所带电荷数 | 1 | 1 | 2 |
| 离子核间距离/10-10m | 2.31 | 3.18 | 2.10 |
| A. | NaF>NaI>MgO | B. | MgO>NaF>NaI | C. | MgO>NaI>NaF | D. | NaI>NaF>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把氯气通入到氯化亚铁溶液中 | B. | 把绿豆大的钾投入无水乙醇中 | ||
| C. | 把碘化钾溶液滴入淀粉溶液中 | D. | 把乙烯通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
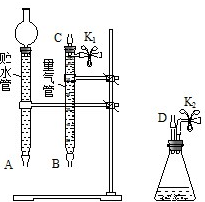 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.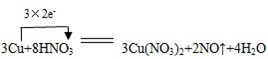 .
.| 实验编号 | 稀硝酸的浓度 /(mol/L) | 稀硝酸的体积 /mL | 温度 /℃ | 时间 /min | 收集气体的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、NO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | Fe3+、S2-、Al3+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 使体积不变,充水蒸气使体系压强增大 | |
| D. | 使压强不变,充氮气使容器体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2只是氧化产物 | B. | H2O是氧化剂 | ||
| C. | CaH2中的H元素被还原 | D. | CaH2是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①中(C6H10O5)n可表示淀粉或纤维素 | |
| B. | 反应②属于氧化反应 | |
| C. | 将在空气中灼烧后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com