
X、Y是元素周期表ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是
A. X原子的电子层数比Y原子的电子层数多
B. X的氢化物的沸点比Y的氢化物的沸点低
C. X的气态氢化物比Y的气态氢化物稳定
D. Y的单质能将X从NaX的溶液中置换出来
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶
 液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
| a | b | c | d | |
| A | Cl— | K+ | CO32— | HCO3— |
| B | K+ | CO32— | Cl— | HCO3— |
| C | K+ | CO32— | HCO3— | Cl— |
| D | K+ | HCO3— | Cl— | CO32— |
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
ഠ
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应生成物的结构简式是
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
(4)17.4克A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积 (标准状况)。(5)A在浓硫酸作用下加热可得到B(B的结构简式为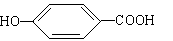 ),其反应类型 。
),其反应类型 。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有 种,写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳的燃烧热为393.5 kJ/mol,下列热化学方程式正确的是
A.C(s)+O2(g)=CO2(g) △H = + 393.5 kJ/mol
B.C(s)+1/2O2(g)=CO(g) △H = - 393.5 kJ/mol
C.C + O2 = CO2 △H = - 393.5 kJ/mol
D.C(s)+O2(g)=CO2(g) △H = - 393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1) △H = -57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H =- Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) +H2O(1) △H =- Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H =- Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出 a kJ的热量。
(1) 写出肼和过氧化氢的电子式:肼: ,过氧化氢: ;
(2) 写出该反应的热化学方程式: ;
(3) 已知H2O(1)==H2O(g) △H= + b kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出 来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。

下列有关该方法的叙述中正确的是 ( )
①能耗大是该方法的一大缺点
②整个过程中,只有一种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.硫酸铝溶液中滴加过量浓氨水:Al3++4NH3·H2O===AlO +4NH
+4NH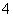 +2H2O
+2H2O
B.乙酸钠溶液显碱性的原因:CH3COO-+H2O===CH3COOH+OH-
C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-===SO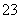 +H2O
+H2O
D.漂白粉放置在空气中变质:ClO-+CO2+H2O===HClO+HCO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com