
某温度下,H2(g)+CO2(g)⇌H2O(g)+CO(g)的平衡常数K= .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
|
| A. | 平衡时,乙中CO2的转化率大于60% |
|
| B. | 平衡时,甲中和丙中H2的转化率均是60% |
|
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
|
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
科目:高中化学 来源: 题型:
下列关于有机物的说法中不正确的是( )
A.正丁烷和异丁烷的熔、沸点不相同
B.乙烯、苯、乙酸分子中的所有原子都在同一平面上
C.C7H16的烷烃中,含有3个甲基的同分异构体有3种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1 452kJ•mol﹣1
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1
下列说法正确的是( )
|
| A. | H2(g)的燃烧热为571.6 kJ•mol﹣1 |
|
| B. |
|
|
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
|
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中发生反应:2A(g)+B(g)⇌2C(g)△H<0.某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究.下列关于图象的分析正确的是( )
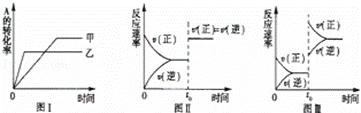
①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度高于甲的温度
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大B的浓度对反应速率的影响.
|
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.0mol PCl3 和2.0mol Cl2 充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)⇌PCl5(g).达到平衡时,PCl5 为0.80mol,如果此时移走2.0mol PCl3 和l.0mol Cl2,在相同温度下再达平衡时PCl5 的物质的量是( )
|
| A. | 大于0.4 mol,小于0.8 mol | B. | 0.4 mol |
|
| C. | 小于0.4 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s) + I2(g)  WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称取0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530 ℃。
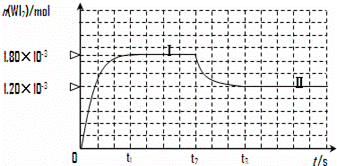
(1)该反应的化学平衡常数表达式为:K=
(2)该反应是 (填“放热”或“吸热”)反应,判断依据是
。
(3)反应从开始到t1(t1= 3 min)时间内的平均速率v(I2)= 。
(4)能够说明上述反应已经达到平衡状态的有 。
a.I2与WI2的浓度相等
b.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子方程式:As2S3+H2O+NO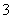 ―→AsO
―→AsO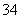 +SO
+SO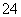 +NO↑+________
+NO↑+________  (未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
(未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
A.配平后水的化学计量数为4 B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28 D.氧化产物为AsO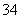 和SO
和SO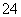
查看答案和解析>>
科目:高中化学 来源: 题型:
面对能源与环境等问题,
全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:
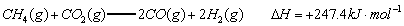
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。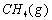 与
与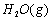 反应生成CO2(g)和
反应生成CO2(g)和 的热化学方程式为 。
的热化学方程式为 。
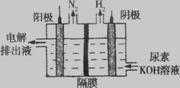
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(3) 是一种储氢合金。350℃时,
是一种储氢合金。350℃时, 与
与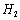 反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。则
反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。则 与
与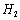 反应的化学方程式为 。
反应的化学方程式为 。
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: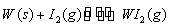 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的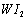 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

(4)该反应是 (填写“放热”或“吸热”)反应。在450℃时,该反应的平衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或 “变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol
WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com