
【题目】一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法中正确的是( )
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
科目:高中化学 来源: 题型:
【题目】已知4P(红磷,s)![]() P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
A.当1mol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 已知25 ℃时NH4CN溶液显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 室温时, 相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时, CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[FeSO4·(NH4)2SO4·6H2O]是一种能溶于水、难溶于酒精的浅蓝绿色晶体,常用于定量分析中配制亚铁离子的标准溶液,实验室用下图所示装置制备摩尔盐。下列说法错误的是
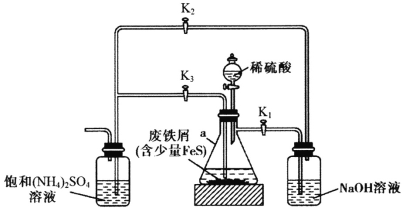
A.铁屑上的少量油污可用煮沸的饱和Na2CO3溶液洗涤,再用蒸馏水洗净
B.用标准摩尔盐滴定酸性KMnO4溶液时不需要外加指示剂
C.实验开始阶段产生的气体是用来排出装置内的空气
D.实验开始时应先打开K1、K3,关闭K2;待a中反应即将完成时,再打开K2,关闭K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A在空气中燃烧生成淡黄色固体;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。
根据以上信息回答下列问题:
(1)写出对应化学式:A______,B______,C______,D______。
(2)A在室温下与氧气反应时生成__________(写化学式,下同),D在空气中锈蚀生成__________。
(3)写出下列化学方程式:
①A在空气中燃烧______________________;
②B与氧气在加热条件下反应______________________;
③C在氧气中燃烧________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质E(普鲁卡因)作为局部麻醉剂,在传导麻醉、浸润麻醉及封闭疗法中均有良好疗效。它的合成路线如下:
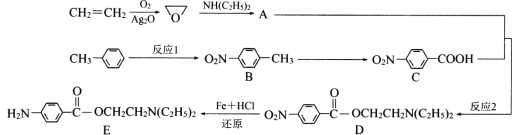
回答下列问题:
(1)A的结构简式为____________,生成C的反应类型为__________________。
(2)D中含氧官能团的名称为______________________。
(3)反应1需加入的无机试剂为_____________________。
(4)一定条件下,E的水解产物之一F能发生自身缩聚,写出该缩聚反应的化学方程式:_____________________________________。F的同分异构体中,遇FeC13溶液显色且能发生银镜反应的共有______种,其中苯环上的一取代物有两种的结构简式为__________。
(5)参照上述合成路线,设计以CH3—CH=CH2为原料(其他试剂任选),制备![]() 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×10—9),其电离方程式为:NH2OH+H2O ![]() NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
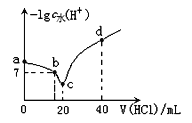
下列说法中错误的是
A.a点对应溶液的pH=9.5
B.c点溶液中存在离子反应: NH3OH++H2O ![]() NH2OH+H3O+
NH2OH+H3O+
C.d点溶液中:—lgc水(H+)=13
D.b点对应的溶液中有:c(NH3OH+)=c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡如图所示.
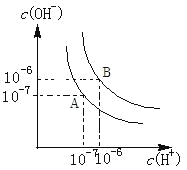
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为___________
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com