
分析 (1)CO2与H2反应生成CH3OH和H2O,根据原子守恒配平书写方程式;
(2)由题意可知,发生反应:2CO+SO2=S+2CO2,根据盖斯定律,①-②-③可得CO与SO2反应的热化学方程式;
(3)发生反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g),根据盖斯定律可知,①-②可得热化学方程式.
解答 解:(1)CO2与H2反应生成CH3OH和H2O,根据原子守恒配后反应方程式为:CO2+3H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OH+H2O,
故答案为:CO2+3H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OH+H2O;
(2)由题意可知,发生反应:2CO+SO2=S+2CO2,
已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol-1
根据盖斯定律,①-②-③可得CO与SO2反应的热化学方程式:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1;
(3)发生反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g),根据盖斯定律可知,①-②可得热化学方程式:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=-957.3kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=-957.3kJ•mol-1.
点评 本题考查根据盖斯定律书写热化学方程式,难度不大,注意对盖斯定律的理解与应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
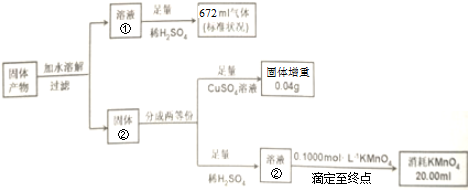
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,有机物A的健线式结构为
,有机物A的健线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有5种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、I-、ClO- | B. | K+、Fe2+、SO42-、NO3- | ||
| C. | K+、Mg2+、Br-SO42- | D. | Na+、K+、Clˉ、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | HCO3- 的电离程度大于HCO3-的水解程度 | |
| D. | 存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2为酸性氧化物 | |
| B. | H2O很稳定是因为水分子之间存在氢键 | |
| C. | 反应③中每生成22.4 LN2,转移电子数1.5NA | |
| D. | NH3的沸点比PH3的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com