
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
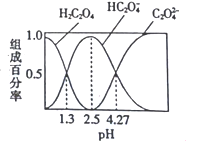
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
【答案】A
【解析】A. 由图可知,pH=4.27 的溶液中c(HC2O4-)=c(C2O42-),此时的溶液中没有H2C2O4,根据电荷守恒得:c(K+)+c(H+)=c(OH)+c(HC2O4)+2c(C2O42),由于c(HC2O4-)=c(C2O42-),则c(K+)+c(H+)=c(OH)+3c(C2O42),故A正确;B. 根据图象分析可知,pH=1.3时,c(H2C2O4)=c(HC2O4-),草酸的一级电离常数为K1=[(HC2O4-)×c(H+)]/c(H2C2O4),则K1=101.3,pH=4.27时,c(HC2O4-)=c(C2O42-),草酸的二级电离常数为K2=[c(C2O42-)×c(H+)]/c(HC2O4-),则K2=104.27,反应HC2O4-+H2O![]() H2C2O4+OH-是HC2O4-的水解反应,平衡常数K=[c(OH)c(H2C2O4)]/c(HC2O4-)=Kw/K1=1012.70,故B错误;C. 向溶液中加KOH溶液,pH由1.3增大至4.27的过程中,溶液始终是酸性的,水的电离受到抑制,随着pH的增大,溶液中酸电离出的H+越来越少,对水的抑制作用不断减弱,水的电离程度不断增大,故C错误;D. 由图可知,pH=2.5时,溶液中不含有H2C2O4和C2O42-,故D错误;答案选A。
H2C2O4+OH-是HC2O4-的水解反应,平衡常数K=[c(OH)c(H2C2O4)]/c(HC2O4-)=Kw/K1=1012.70,故B错误;C. 向溶液中加KOH溶液,pH由1.3增大至4.27的过程中,溶液始终是酸性的,水的电离受到抑制,随着pH的增大,溶液中酸电离出的H+越来越少,对水的抑制作用不断减弱,水的电离程度不断增大,故C错误;D. 由图可知,pH=2.5时,溶液中不含有H2C2O4和C2O42-,故D错误;答案选A。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA
B. 25℃、1.01×105Pa条件下,11.2L丙炔分子中所含碳氢键数为2NA
C. 常温下,2.7g铝分别与足量的盐酸或烧碱溶液反应时,失去的电子数都为0.3NA
D. 1molNO2与足量H20反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
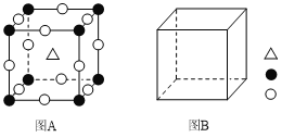
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
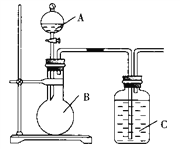
已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是___________________________
(2)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明硫的非金属性比氯的非金属性________(填“强”或“弱”或“无法判断”)。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂________________,实验现象为_________________________该装置存在不足之处,改进措施为:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0gSiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46gNO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
① 甲硅烷(SiH4)固态时属于___________晶体。
② 已知室温下1 g甲硅烷自燃生成SiO2和液态水放出热量44.6 kJ,则其热化学方程式为______________________。
(2)甲醇燃料电池的总反应为:2CH3OH+3O2═2CO2↑+4H2O,其工作原理如下图所示。
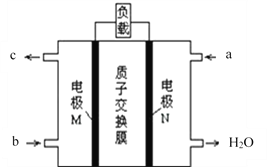
①图中CH3OH从_____________(填a或b)通入,该电池的正极是____________(填M或N)电极,其中在N极发生的电极反应式是_____________________。
②如果在外电路中有1mol电子转移,则消耗标准状况下O2的体积为_______L。
(3)25℃,101kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图所示:
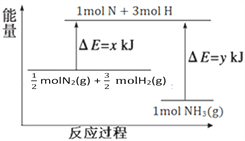
已知:① x = 1127;
② 25℃ 101kPa下,N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol—1。
2NH3(g)△H=-92kJ·mol—1。
则 y =__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%. 
(1)A的化学式为; F的化学式为;
(2)反应③的化学方程式:;
(3)反应②的离子方程式:;
(4)反应④的离子方程式:;
(5)已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中正确的是
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.原电池工作时,实现了将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com