
【题目】室温时,0.1 mol/L某酸HA溶液的pH=3。关于该溶液叙述正确的是
A. 溶质的电离方程式为HA→H+ + A- B. 升高温度,溶液的pH增大
C. 若加入少量NaA固体,则c(A-)降低 D. 该溶液稀释10倍后,pH < 4
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.K+的结构示意图: ![]()
B.B、基态氮原子的电子排布图 ![]()
C.水的电子式: ![]()
D.D、基态铬原子(24Cr)的价电子排布式:3d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羚羊角或犀牛角是治疗创伤的中药方剂中用量极少的成分,但是缺少这味药,疗效将大大下降甚至无效。已知动物的角主要由死亡细胞的角化(变性)蛋白质组成,则羚羊角等的有效成分最可能是( )
A. 特殊活性的蛋白质
B. DNA
C. 微量元素
D. 大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是用途广泛的金属元素.
(1)工业生产过程中易产生有害的含铬废水,含铬废水中存在下列平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+ . 处理该废水常用还原沉淀法,其流程如图所示.
已知:Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31
含铬废水 ![]() 含Cr2O
含Cr2O ![]() 的沸水
的沸水 ![]() 含Cr3+的沸水
含Cr3+的沸水 ![]() Cr(OH)3沉淀
Cr(OH)3沉淀
①Cr2O72﹣中铬元素化合价为 .
②第I步转化控制溶液的pH=2,该溶液显色.
③第Ⅲ步沉淀反应后,溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则c(Cr3+)=molL﹣1 .
(2)室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.
①用离子方程式表示Na2CrO4溶液中的转化反应 .
②根据A点数据,计算该反应的平衡常数值为 . 由图可知,溶液酸性增强,CrO42﹣平衡转化率(填“增大”“减小”或“不变”).
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H0(填“大于”“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
A. 反应物的总能量高于生成物的总能量
B. 若生成2mol液态水,则放出的热量大于148.9 kJ
C. 当v正(HF)=2v逆(H2O)时,反应达到平衡状态
D. 平衡后放出的热量随加入SiO2量的增加而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小苏打是一种常用的食品添加剂。
(1)精制食盐是制备小苏打的原料之一。粗盐中含有少量Ca2+、Mg2+、SO42-,粗盐精制的步骤顺序是:溶解→ → → → (填字母编号)。_____________
a.加盐酸调pH b.加Ba(OH)2溶液 c.加Na2CO3溶液 d.过滤
(2)NH3、CO2先后通入饱和食盐水中,反应的离子方程式________________。
(3)侯氏制碱法中,母液的处理方法是通入氨气,再加入细小食盐颗粒,最后冷却析出的副产品是_______;简述通氨气的作用____________________________________。
(4)称取2.640 g小苏打样品(含少量NaCl),配置成250 mL溶液,准确取出20.00 mL溶液于锥形瓶中,滴加_______作指示剂,滴定时消耗0.1000 mol/L盐酸的体积为20.67 mL。则该样品中碳酸氢钠的质量分数为_________(保留两位小数)。若装标准溶液的滴定管没有润洗,则测得的结果会____(填“偏大”、“偏小”或“不变”)。
(5)测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。实验需使用的定量仪器是_____;写出涉及的化学方程式__________________。
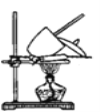
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.用银氨溶液检验某病人是否患糖尿病
B.酶不属于蛋白质
C.在植物油中滴入溴水,溴水褪色
D.在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的______极,电极反应式为____,发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com