
①加适量H2SO4溶液 ②加金属钠 ③结晶 ④加过量NaOH溶液 ⑤加强热脱结晶水 ⑥过滤
A.②⑥③ B.④⑥①③ C.④⑥③⑤ D.②⑥①③⑤
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?黄山模拟)如图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图.请认真读图分析,回答有关问题.
(2011?黄山模拟)如图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图.请认真读图分析,回答有关问题.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 16(w-m) |
| n-w |
| 16(w-m) |
| n-w |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三4月高考预测(二模)化学试卷(解析版) 题型:实验题
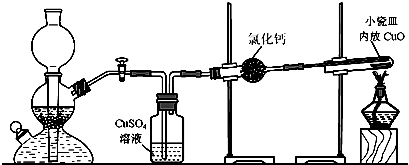
实验室用粗锌与稀硫酸反应制取氢气,利用氢气还原氧化铜来测定铜的相对原子质量。实验装置如下:

在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是①适当增大硫酸的浓度,②_______________________。
用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是_______________,是否可以将CuSO4溶液换成浓硫酸_________(答“是”或“否”) ;理由是__________________________。
有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的简单化学方法_________________________________________。
实验中得到的数据有:小瓷皿的质量mg,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是____________(用含m、n、w的代数式表示)。
某次实验中测定结果明显偏大,可能的原因是________(选填编号)。
a.未充分冷却即停止通氢气 b.氧化铜样品中含有氯化铵杂质
c.反应后固体中有少量Cu2O d.氢气不干燥有少量水分
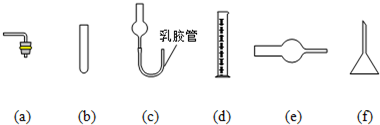
由于启普发生器药品用量较多,利用下列仪器装配一套有启普发生器功能的简易装置,你选择____________(选填编号) (支撑仪器、橡皮塞、导气管略)。

(a) (b) (c) (d) (e) (f)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三上学期第三次月考化学试卷(普) 题型:选择题
(12分)下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。

⑴下列叙述中正确的是(填序号) 。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越大
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已
C.硝酸的浓度越大,还原产物中N元素低化合价产物越多
D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2
⑵当硝酸溶液的密度为1.36 g·cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号) 。
A.2Fe + 10HNO3 == 2Fe(NO3)3 + NO↑+3NO2↑+5H2O
B.4Fe + 18HNO3 == 4Fe(NO3)3 + 3NO↑+3NO2↑+9H2O
C.3Fe + 12HNO3 == 2Fe(NO3)3 + Fe(NO3)2 + 2NO↑+2NO2↑+3H2O
⑶密度为1.26 g·cm-3,质量分数为50.0 %的硝酸,其物质的量浓度是 mol·L-1。
⑷限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。

第1步:反应并收集生成的气体:
①实验中气体发生装置应选择哪种装置及理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④ 取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省黄山市高三七校联考化学试卷 题型:填空题
(14分)下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。

⑴下列叙述中正确的是(填序号) 。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越大。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越多。
D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2
⑵ 当硝酸溶液的密度为1.36 g·cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号) 。
A.2Fe + 10HNO3 == 2Fe(NO3)3 + NO↑+3NO2↑+5H2O
B.4Fe + 18HNO3 == 4Fe(NO3)3 + 3NO↑+3NO2↑+9H2O
C.3Fe + 12HNO3 == 2Fe(NO3)3 + Fe(NO3)2 + 2NO↑+2NO2↑+3H2O
⑶ 密度为1.26 g·cm-3,质量分数为50.0 %的硝酸,其物质的量浓度是 mol·L-1。
⑷ 限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。

第1步:反应并收集生成的气体:
①实验中气体发生装置应选择 (填装置序号),理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④ 取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com