
【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
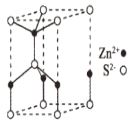
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)
【答案】![]() 球形 Zn的价电子排布式是3d104s2,4s能级上电子处于全充满状态,较稳定,难以失去电子;而镓(31Ga)的价电子排布式为4s24p1,容易失去4p能级上的一个电子,故Ga的第一电离能比Zn的低
球形 Zn的价电子排布式是3d104s2,4s能级上电子处于全充满状态,较稳定,难以失去电子;而镓(31Ga)的价电子排布式为4s24p1,容易失去4p能级上的一个电子,故Ga的第一电离能比Zn的低 ![]() 16 ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,相对分子质量依次增大,分子间作用力逐渐增强,故熔点依次升高 ZnF2属于离子晶体,熔化时需要破坏离子键,而其它三种晶体属于分子晶体,离子键的强度大于分子间作用力,故其熔点远高于其它三种卤化锌 4
16 ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,相对分子质量依次增大,分子间作用力逐渐增强,故熔点依次升高 ZnF2属于离子晶体,熔化时需要破坏离子键,而其它三种晶体属于分子晶体,离子键的强度大于分子间作用力,故其熔点远高于其它三种卤化锌 4 ![]() ×100%
×100%
【解析】
(1)对于主族元素来说,价电子就是最外层电子,但对于Zn来说,它是副族(ⅡB),其价电子还与3d能级上的电子有关;当电子排布完成后,4s能级上的电子能量最高,4s能级电子云是球形;
(2)Zn与Ga在周期表中虽然是相邻元素,但价电子不一样,Zn的价电子排布式是3d104s2,而Ga的价电子排布式为4s24p1,结合洪特规则判断;
(3)①CN-与N2、CO是等电子体,它们的结构相似,其中N2的结构式为![]() ;
;
②双键碳和双键氮以及苯环碳均是sp2杂化;
(4)ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,而ZnF2属于离子晶体,它们的熔沸点由于晶体类型不同,影响它们熔沸点的作用力不同,应区别对待;
(5)这种ZnS晶胞不属于立方晶胞,上下两个底面是平行四边形,两个角呈120°、另两个角呈60°,这就决定了处于晶胞顶点上的8个S2-,有4个被12个晶胞共用,另4个被6个晶胞共用;处于棱上的4个Zn2+,有2个被6个晶胞共用、另2个被3个晶胞共用,这样就可以求出晶胞的组成。再根据密度与质量、体积的关系以及球的体积公式即可求得离子占晶胞体积的百分率。
(1)Zn的原子序数为30,其价电子排布式为3d104s2,价层电子轨道表达式为:![]() ;占据最高能层的电子处于4s能级上,所以是球形;
;占据最高能层的电子处于4s能级上,所以是球形;
(2)第一电离能是从气态基态原子中去掉一个电子所需的能量,Zn的价电子排布式是3d104s2,4s能级上电子处于全充满状态,较稳定,难以失去电子;而镓(31Ga)的价电子排布式为4s24p1,容易失去4p能级上的一个电子,故Ga的第一电离能比Zn的低;
(3)①CN-与N2互为等电子体,等电子体具有相似的结构。N2的结构式为![]() ,故CN-的电子式为
,故CN-的电子式为![]() ;
;
②每个二苯硫腙分子中,2个苯环的12个碳原子为sp2杂化,形成双键的硫原子、碳原子和2个氮原子也为sp2杂化,共计16个;
(4)①分子晶体熔沸点由分子间作用力大小决定,ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,相对分子质量依次增大,分子间作用力逐渐增强,故熔点依次升高;
②晶体的熔沸点决定于晶体类型,一般来说熔沸点是:原子晶体>离子晶体>分子晶体,ZnF2属于离子晶体,熔化时需要破坏离子键,而其它三种晶体属于分子晶体,离子键的强度大于分子间作用力,故其熔点远高于其它三种卤化锌;
(5)①由晶胞结构可知,每个Zn2+周围连有4个O2-,配位数为4;
②该一个晶胞中含有S2-的数目为:![]() ×4+
×4+![]() ×4+1=2;含Zn2+的数目为:
×4+1=2;含Zn2+的数目为:![]() ×2+
×2+![]() ×2+1=2。即一个晶胞中含有2个ZnS,根据密度与质量、体积的关系可以求出一个晶胞的体积,即:d=
×2+1=2。即一个晶胞中含有2个ZnS,根据密度与质量、体积的关系可以求出一个晶胞的体积,即:d=![]() cm3,S2-、Zn2+可以看做刚性球,球的体积公式是
cm3,S2-、Zn2+可以看做刚性球,球的体积公式是![]()
![]() r3,故该晶胞中离子的体积占晶胞体积的百分率为:
r3,故该晶胞中离子的体积占晶胞体积的百分率为: ×100%=
×100%=![]() ×100%。
×100%。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A. 该有机物的分子式为C7H7O3
B. 该有机物能发生取代、加成和氧化反应
C. 1mol该有机物最多能与2mol H2发生加成反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
B. 物质的量浓度为0.5mol/LAlCl3溶液中,含有Cl-个数为1.5NA
C. 6g乙烷中含有的共价键的数目为1.4NA
D. l mol甲基(- CH3)所含电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO用途广泛,对其进行研究具有重要的价值和意义
(1)2NO(g)+O2(g)=2NO2(g)△H=akJmol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1
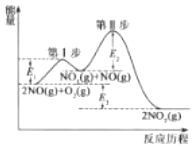
①第I步反应的热化学方程式为__。
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是__。
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)N2(g)+2H2O(g)。研究表明:某温度时,v正=kcm(NO)cn(H2),其中k=2.5×103mol(m+n-1)L(m+n-1)s-1.该温度下,当c(H2)=4.0×10-3molL-1时,实验测得v正与c(NO)的关系如图一所示,则m=___,n=___。
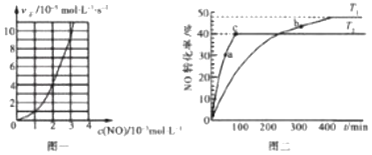
(3)NO易发生二聚反应2NO(g)N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H___0(填“>”“<”或“=”)。
②T1温度下,欲提高NO的平衡转化率,可采取的措施为__(任写一条即可)。
③a、b处正反应速率va__vb(填”>”“<”或“=”),原因为___。
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=___kPa-1(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3mol A和2.5mol B混合于2L恒容的密闭容器中,保持温度不变发生的反应如下:3A(g)+B(g)![]() xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
A.A的平均反应速率为0.10mol/(L·s)
B.平衡时,B的转化率为20%
C.平衡时,C的浓度为0.125mol/L
D.平衡时,容器内压强为原来的0.8倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
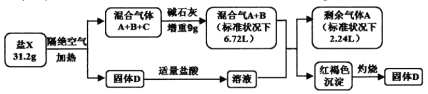
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________。
(3)写出盐X隔绝空气加热分解的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中短周期主族元素W、X、Y、Z,原予序数依次增大,W的液态单质应用于航天领域,是火箭起飞的重要燃料;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z元素原子在同周期中原子半径最小。下列说法错误的是( )
A.Z的单质与W、Y的单质都能反应,且反应中Z的单质都作氧化剂
B.X的单质与Y的单质在常温条件下反应生成化合物甲,用电子式表示甲的形成过程为:![]()
C.Y与W可以形成原子个数比为1:1的化合物乙,且乙与水反应有气体产生
D.W与X形成的含有极性共价键的化合物不只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com