
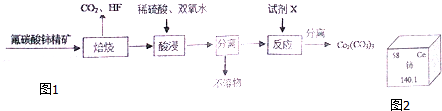
分析 碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,可由氟碳酸铈精矿经氧化煅烧生成二氧化铈(CeO2),二氧化铈(CeO2)可在酸性条件下被还原为+3价的铈盐,通过加入Na2CO3溶液,从而制得碳酸铈[Ce2(CO3)3].
(1)根据铈在元素周期表的位置可知,铈是58号元素,即质子数为58,化合物中各元素化合价之和为0,据此判断铈的化合价;
(2)二氧化铈的Ce为+4价,在酸浸时,固体CeO2被溶解,且被双氧水还原为了+3价的Ce3+;
(3)根据流程分析可知,在酸浸后,为得到Ce2(CO3)3沉淀,加入Na2CO3溶液,过滤得到Ce2(CO3)3;
(4)根据溶度积定义书写表达式,结合溶度积计算离子浓度;
(5)加硫酸溶解后,用0.1000mol•L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),有关系n[Ce(OH)4]=n(FeSO4)成立,据此计算,用氯化亚铁代替硫酸亚铁,氯离子能被Ce4+氧化,所以会使氯化亚铁的体积偏小,据此分析.
解答 解:碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,可由氟碳酸铈精矿经氧化煅烧生成二氧化铈(CeO2),二氧化铈(CeO2)可在酸性条件下被还原为+3价的铈盐,通过加入Na2CO3溶液,从而制得碳酸铈[Ce2(CO3)3],
(1)根据铈在元素周期表的位置可知,铈是58号元素,即质子数为58,化合物中各元素化合价之和为0,CeFCO3中Ce的化合价为x,则x+(-1)+(+4)+(-2)×3=0,x=+3,
故答案为:58;+3;
(2)二氧化铈的Ce为+4价,在酸浸时,固体CeO2 被溶解,且被双氧水还原为了+3价的Ce3+,在酸性条件下发生氧化还原反应,方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)在酸浸后,经过分离不溶物,得到含有Ce3+的溶液,加入Na2CO3溶液,中和(2)中酸液,使Ce3+转化为Ce2(CO3)3沉淀,经过过滤得到Ce2(CO3)3,
故答案为:Na2CO3;
(4)溶度积为溶液离子浓度的幂次方的乘积,Ce(OH)4的溶度积表达式为Ksp=c(Ce4+)•[c(OH-)]4,使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol•L-1,
则c(OH-)>$\frac{Ksp}{c(Ce{\;}^{4+})}$=$\root{4}{\frac{1×10{\;}^{-29}}{1×10{\;}^{-5}}}$mol/L=1×10-6mol/L,则pH=8,
故答案为:c(Ce4+)•[c(OH-)]4;8;
(5)Ce(OH)4产品在用硫酸溶解后生成了Ce4+,所以用还原剂滴定该溶液,Ce4+变成了Ce3+,而Fe2+被氧化成了Fe3+,所以根据电子的是守恒计算,n[Ce(OH)4]=n(FeSO4)=cV=0.1000 mol•L-1×V×10-3L=$\frac{1.00g×97%}{208g/mol}$,V=46.6,用氯化亚铁代替硫酸亚铁,氯离子能被Ce4+氧化,所以会使氯化亚铁的体积偏小,所以测得的Ce(OH)4产品的质量分数偏低,
故答案为:46.6;偏低.
点评 本题工艺流程为基础,考查化学实验基本操作、铈等元素的单质及化合物的知识及应用、化学计算、氧化还原反应等相关知识,难度较大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备氯气是利用了二氧化锰的还原性 | |
| B. | 实验室制备氯气时使用过量的浓盐酸可使二氧化锰完全反应 | |
| C. | 用金属与氯气直接化合或金属与盐酸反应都可制得FeCl2 | |
| D. | 将Cl2与HCl混合气体通过四氯化碳可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2气体这入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HCLO | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液的pH=7:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向Ca(H2PO4)2溶液中滴入过量的NaOH溶液:3Ca2++6H2PO4-+12OH-═Ca3(PO4)2↓+12H2O+$4PO_{4}^{-}}$ | |
| D. | 112mL(S.T.P)Cl2通入10ml1mol/L的FeBr2溶液:2Fe2++4Br-+3CL2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com