
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。

【答案】 S 1.2 2.5a 2CuS+O2+2H2SO4![]() CuSO4+2H2O+2S 污染小,同时得到副产物硫酸亚铁晶体及硫黄,资源得到充分利用 蒸发浓缩、冷却结晶(过滤不写不扣分) A
CuSO4+2H2O+2S 污染小,同时得到副产物硫酸亚铁晶体及硫黄,资源得到充分利用 蒸发浓缩、冷却结晶(过滤不写不扣分) A
【解析】(1)①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO中S元素的化合价从+2升高为+4价,被氧化;②2Cu2S+3O2
Cu2S+3SO2+2FeO中S元素的化合价从+2升高为+4价,被氧化;②2Cu2S+3O2![]() 2Cu2O+2SO2中S元素的化合价从-2升高为+4价,被氧化;③2Cu2O+Cu2S
2Cu2O+2SO2中S元素的化合价从-2升高为+4价,被氧化;③2Cu2O+Cu2S![]() 6Cu+SO2↑中S元素的化合价从+2升高为+4价,被氧化;则在反应①、②、③中被氧化的元素为S元素;若生成的SO2在标准状况下体积为4.48L,生成SO2的物质的量为
6Cu+SO2↑中S元素的化合价从+2升高为+4价,被氧化;则在反应①、②、③中被氧化的元素为S元素;若生成的SO2在标准状况下体积为4.48L,生成SO2的物质的量为![]() =0.2mol,则发生转移的电子数目为0.2mol×6NA=1.2NA;amolCuFeS2生成
=0.2mol,则发生转移的电子数目为0.2mol×6NA=1.2NA;amolCuFeS2生成![]() molCu2S,消耗2amolO2,
molCu2S,消耗2amolO2,![]() amolCu2S氧化为Cu2O,消耗O2
amolCu2S氧化为Cu2O,消耗O2![]() amol
amol![]() =0.5amol,共消耗2.5amolO2;
=0.5amol,共消耗2.5amolO2;
(2)依据流程转化可知,反应Ⅰ是硫化铜和氧气、硫酸发生氧化还原反应生成硫酸铜、硫和水,反应的化学方程式为:2CuS+O2+2H2SO4=2CuSO4+2S+2H2O,火法炼钢中产生有毒的二氧化硫,而湿法炼铜中不产生有毒气体,故其污染性小、环保,同时湿法炼铜还得到副产品硫酸亚铁晶体及其硫磺,充分利用了资源;
(3通过将溶液蒸发浓缩、冷却结晶并过滤即可得到FeSO4·7H2O;
(4)从图1可以看出,铜的浸出率随反应温度升高二增大,在为的达到95°C后,铜的浸出率随温度的变化不明显,但温度过高能耗增加,由此可知适应的反应温度为95°C,图3可以看出:固液比大于1︰5时,铜的浸出率随固液比的增大而有所减小;固液比小于1︰5时铜的浸出率随固液比的减小而有所下降,因此适宜的固液比为1︰5;从图4可以看出铜的浸出率随反应时间增大而增大,但在反应时间超出7h后,随反应时间的延长铜的浸出率增大的很缓慢,同时反应时间过长,即增加能耗,有降低设备利用率,故适宜的反应时间7h;表中数据变化分析,加入氯离子能改变铜的浸出效果,但氯离子浓度超过0.8mol/L,时铜的浸出率随氯离子浓度增加反而减小,故适宜的氯离子浓度维持在0.8mol/L;
故答案为A。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B. 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C. 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D. 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,有下列说法:
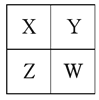
若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
④若四种元素只有一定为金属,则Z与Y的最高价氧化物对应的水化物一定为强酸。
其中不正确的说法有几项
A. 1项 B. 2项 C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是三类重要的营养物质,葡萄糖的分子式是 ,由于它 , 所以属于单糖;蔗糖的分子式是 ,由于它的一个分子能水解成两个单糖分子,所以属于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E在周期表中的位置为____________________;B2F4的电子式_________________。
(2)B的最高价氧化物的水化物与其氢化物反应生成Z,则Z的名称为_______________,Z的化学键类型为____________________。
(3)可以比较C和E得电子能力强弱的是___________________(填写编号) 。
a.比较这两种元素最高正价的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
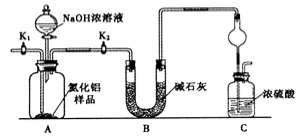
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
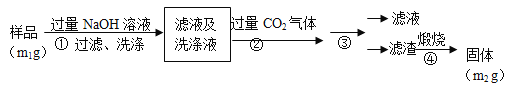
(4)步骤②生成沉淀的离子方程式为_________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com