
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子:${\;}_{6}^{12}$C | B. | HClO的结构式:H-Cl-O | ||
| C. | N2H4的电子式: | D. | 甲酸的分子式:CH2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 氧化铝 | C. | 氢氧化钠 | D. | 氢氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验Cl-离子的试剂是硝酸银和硝酸 | |
| B. | 检验SO42-离子的试剂是氯化钡和盐酸 | |
| C. | 检验CO32-离子的试剂是盐酸和澄清石灰水 | |
| D. | 向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 | |
| C. | 在$\frac{{c({H^+})}}{{c(O{H^-})}}$=10-12.溶液中Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
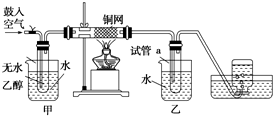 某实验如图.
某实验如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com