
| A. | CuO、MgO、Na2O2均属于碱性氧化物 | B. | 盐酸、醋酸、苯酚均属于强电解质 | ||
| C. | CO2、CCl4、蛋白质均属于有机物 | D. | 液氯、晶体硅、臭氧均属于单质 |
分析 A.碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
B.水溶液中能完全电离的电解质为强电解质;
C.有机物是指含有碳元素的化合物.无机物是指不含有碳元素的化合物.一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物;
D.单质是由同种元素的原子组成的纯净物.
解答 解:A.因过氧化钠与酸反应生成盐、水和氧气,则过氧化钠不属于碱性氧化物,故A错误;
B.醋酸和苯酚在水溶液中部分电离,属于弱电解质,故B错误;
C.CO2属于无机物,故C错误;
D.液氯、晶体硅、臭氧均是由同种元素的原子组成的纯净物,属于单质,故D正确.
故选D.
点评 本题考查物质的分类,明确相关的概念是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
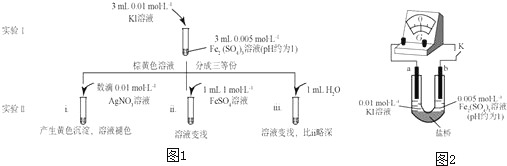
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的氧化铜粉末 | B. | 二氧化碳通过过氧化钠粉末 | ||
| C. | 铝与氧化铁发生铝热反应 | D. | 将锌粒投入硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42--完全沉淀 | |
| D. | 若将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.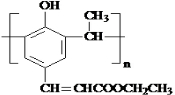 .
.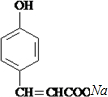 +
+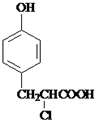 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>R>T | |
| B. | 气态氢化物的稳定性:W<R<T | |
| C. | 最高价氧化物对应的水化物的碱性:X>Z | |
| D. | XR2、WR2两种化合物中R的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2通入含有1 mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| B. | 用两根铜棒作电极电解盐酸:2H-+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com