
将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为( )
A. 1:1 B. 1:2 C. 3:4 D. 1:8
考点: 化学方程式的有关计算.
分析: 在密度容器中,在相同温度下,气体的物质的量之比等于压强之比,若气体充分混合,可发生:SO2+2H2S=3S+2H2O;NH3+HCl=NH4Cl,结合反应的方程式计算反应后气体的物质的量,可计算混和后容器中的压强与原容器中的压强之比.
解答: 解:SO2+2H2S=3S+2H2O,NH3+HCl=NH4Cl,如果把容器的体积认为是2V,四个容器的体积为8V,那么各气体充分混合后,只剩余体积为V的SO2,所以,混合后容器中的压强与原容器中的压强之比为1:8,故选D.
点评: 本题考查化学方程式的计算,难度不大,注意把握相关物质的性质以及可能发生的反应,根据反应判断反应后容器内的气体,为解答该题的关键.


科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe,I2,他们使用的药品和装置如如所示.
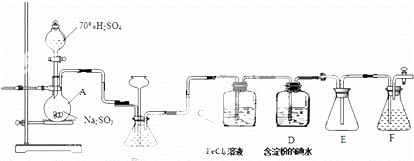
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好.装置E的作用是 .装置F中为NaOH溶液.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是 (填离子符号).
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是 .
(5)能表明I﹣的还原性弱于SO2的现象是 ,写出有关离子方程式: ﹣.
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,
(1))请写出NO2和CO反应的热 化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
则反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)⇌2N2O5(g);已知体系中n(NO2)随时间变化如表:
t(s) 0 500 1000 1500
N(NO2)(mol) 20 13.96 10.08 10.08
写出该反应的平衡常数表达式:K= ,
已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”).

查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol C10H22含共价键数目32NA
B. 常温常压下,8g CH4含有电子数目5NA
C. 1L 0.1mol•L﹣1的醋酸溶液中含有CH3COO﹣的数目0.1NA
D. 78g苯含有C=C双键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是( )
A. Ca2+、Cl﹣、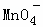 、Na+ B. K+、Cl﹣、
、Na+ B. K+、Cl﹣、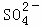 、H+
、H+
C. OH﹣、Na+、Al3+、I﹣ D. H+、Cl﹣、Ba2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17.
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是
(2)Y是 ,Z是 ,W是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.写出该化合物的名称及化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是()
组别 c(HCl)(mol/L) 温度(℃) 状态
1 2.0 25 块状
2 2.5 30 块状
3 2.5 50 块状
4 2.5 30 粉末状
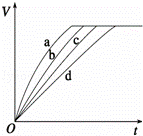
A. 4﹣3﹣2﹣1 B. 1﹣2﹣3﹣4 C. 3﹣4﹣2﹣1 D. 1﹣2﹣4﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L•s),10s后容器内的B的物质的量为()
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
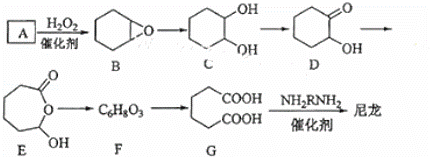
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为 .
(2)B到C的反应类型为 .
(3)F的结构简式为 .
(4)在上述中间物质中,核磁共振氢谱出峰最多的是DE,最少的是F.(填化合物代号)
(5)由G合成尼龙的化学方程式为 .
(6)由A通过两步反应制备1,3﹣环已二烯的合成路 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com