
下述实验不能达到预期实验目的的是( )
序号实验内容实验目的
A将2.5gCuSO4·5H2O溶解在97.5g水中配制质量分数为1.6%的CuSO4溶液
B向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液说明一种沉淀能转化为另一种溶解度更小的沉淀
C室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱
D室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响
C
【解析】
试题分析:A、2.5gCuSO4?5H2O中CuSO4的质量为1.6g,溶液的质量为100g,所配溶液中硫酸铜的质量分数为1.6%,正确;B、硫化银比氯化银更难溶,向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液,氯化银会转化为黑色沉淀硫化银,说明一种沉淀能转化为另一种更难溶的沉淀,正确;C、NaClO溶液具有强氧化性,能漂白pH试纸,不能测出NaClO溶液的pH,则不能用pH试纸测定浓度为0.1mol?L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH来比较HClO和CH3COOH的酸性强弱,可用酸度计测定,错误;D、室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸,研究浓度对反应速率的影响,正确。
考点:考查实验方案的评价,涉及溶液的配制、沉淀的转化、盐类的水解、影响反应速率的因素等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
反应CO+H2O(g) CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
A.将压强减小至原来的一半 B.将反应温度升高
C.添加催化剂 D.增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:选择题
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )

A.物质Z的化学计量数a = 2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:填空题
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:

(1)加入新制氯水后溶液中发生的离子反应方程式是_________________________、
Fe3+ +SCN- [Fe(SCN) ]2+ 。
[Fe(SCN) ]2+ 。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水B.稀盐酸C.稀硫酸D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。

(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述正确的是 ( )
A.用该电池电解CuCl2溶液产生2.24LCl2时,有0.2mol电子转移
B.金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性
C.电池工作(放电)过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中: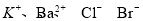
B.常温下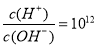 的溶液中:
的溶液中: 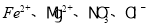
C.含有大量Al3+的溶液中: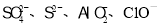
D.常温下pH为7的溶液中: K+、Fe3+ 、 Cl- 、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:填空题
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为 ;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极 ,阳极 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
化学与生活、生产息息相关,下列说法不正确的是
A.煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源
B.测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义
C.利用盐类的水解反应可以制备胶体对饮用水进行净化,也可以获得纳米材料
D.通常条件下能够自发进行的反应必须具备△H和△S均小于零
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:选择题
下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号金属(粉末状)酸的浓度酸的体积反应温度
A0.1mol Mg6mol/L硝酸10mL30℃
B0.1mol Mg3mol/L盐酸10mL60℃
C0.1mol Fe3mol/L盐酸10mL60℃
D0.1mol Mg3mol/L盐酸10mL30℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com