
| A. | 某温度下,Ksp(AgCl)=1.8×10-10,Ksp (Ag2CrO4)=1.9×10-12,故Ag2CrO4更难溶 | |
| B. | 在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 在AgCl饱和溶液中,加入AgCl固体,平衡不移动 |
分析 A.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀;
B.加入CaCl2固体,Ca2+浓度增大;
C.如升高温度,溶解度降低,则溶度积减小;
D.为饱和溶液,加入固体,浓度不变.
解答 解:A.AgCl饱和所需Ag+浓度c(Ag+)=$\frac{Ksp(AgCl)}{C(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{0.01}$=1.8×10-8mol/L,Ag2CrO4饱和所需Ag+浓度c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{1.9×1{0}^{-12}}{0.001}}$mol/L=4.36×10-5mol/L,则1.8×10-8mol/L<4.36×10-5mol/L,所以Cl-先沉淀,则AgCl更难溶,故A错误;
B.加入CaCl2固体,虽然平衡逆向移动,但Ca2+浓度增大,故B错误;
C.如升高温度,溶解度降低,则溶度积减小,故C错误;
D.为饱和溶液,加入固体,浓度不变,平衡不移动,故D正确.
故选D.
点评 本题考查了难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析、计算能力的考查,易错点为A,注意根据Ksp计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 河流三角洲的形成与胶体的性质无关 | |
| B. | 清晨在密林中看到的一缕缕光束,是丁达尔现象的表现 | |
| C. | 向沸水中逐滴加入FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体 | |
| D. | 胶体粒子的直径大小在1~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
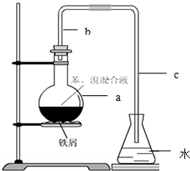
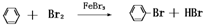 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com