
| A. | 还原剂只有锂 | |
| B. | SOCl2中每个原子都达到8电子稳定结构 | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | 生成1.12 LSO2时,反应转移电子为0.2 mol |
分析 4Li+2SOCl2═4LiCl+S+SO2中,Li元素的化合价由0升高为+1价,S元素的化合价由+4价降低为0,以此来解答.
解答 解:A.Li元素的化合价升高,则Li为还原剂,故A正确;
B.SOCl2中S原子成2个S-Cl键,1个S=O,S原子超过8个电子,故B错误;
C.Li的化合价升高被氧化,LiCl是氧化产物,故C错误;
D.反应4Li+2SOCl2═4LiCl+S+SO2中,每生成1mol SO2转移4mol电子,则标准状况下生成1.12LSO2时,反应转移电子为0.2mol,故D错误.
故选A.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO3-+2H+═CO2↑+H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 硫酸铜溶液中加入过量铁粉:Cu2++2Fe═2Fe3++Cu | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
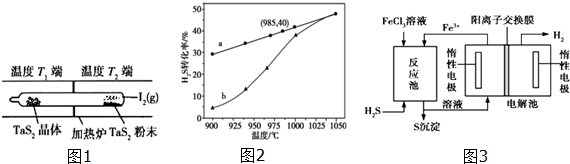
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
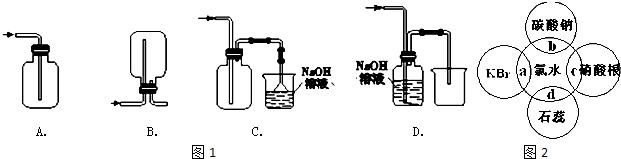
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol烃基与17gNH3所含电子数之比为9:10 | |
| D. | 一定温度下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl含NH4+的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com