
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
分析 (1)①设平衡时CO2的物质的量为xmol,利用三段式表示出平衡时各组分物质的量、各组分物质的量变化量,由于反应前气体化学计量数都是1,可以用物质的量代替浓度代入平衡常数计算x的值,再根据v=$\frac{△c}{△t}$计算v(CO2),进而计算CO的转化率;
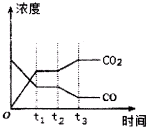
②由图可知,t2时刻后二氧化碳浓度增大,一氧化碳浓度减小,改变条件,平衡向正反应方向移动,结合平衡移动原理与反应特点分析解答;
(2)①I中正逆速率相等,处于平衡状态,根据I中数据计算该温度下平衡常数,再计算Ⅱ中浓度商,与平衡常数比较判断反应进行情况,进而确定正、逆反应速率关系;
②设平衡时CO的浓度变化量为xmol/L,利用三段式表示平衡时各组分的浓度,再利用平衡常数列方程计算;
(3)等体积混合后溶液中碳酸根的浓度为1×l0-4mol/L,利用溶度积计算需要钙离子浓度,再根据稀释定律计算所需CaCl2溶液的最小浓度.
解答 解:(1)设平衡时CO2的物质的量为xmol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol):0.2 0.2 0 0
转化(mol):x x x x
平衡(mol):0.2-x 0.2-x x x
K=$\frac{x×x}{(0.2-x)×(0.2-x)}$=1,解得x=0.1mol
v(CO2)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L.min),
一氧化碳转化率为:$\frac{0.1mol}{0.2mol}$×100%=50%,
故答案为:0.01mol/(L.min);50%;
②由图可知,t2时刻后二氧化碳浓度增大,一氧化碳浓度减小,改变条件,平衡向正反应方向移动,反应是放热反应,可减低温度使平衡正向进行,或降低氢气的浓度或增大水蒸气的浓度,使平衡向正反应方向移动,
故答案为:降低温度或降低H2浓度或增大H2O(g)浓度;
(2)①I中正逆速率相等,处于平衡状态,该温度下平衡常数K=$\frac{4.0×1{0}^{-2}}{2.0×1{0}^{-4}×(4.0×1{0}^{-4})^{\frac{1}{2}}}$=104,Ⅱ中浓度商Qc=$\frac{5×1{0}^{-2}}{3×1{0}^{-4}×(4×1{0}^{-4})^{\frac{1}{2}}}$=8.3×103<104,故反应向正反应进行,则v(正)>v(逆),
故答案为:>;
②设CO的浓度变化量为xmol/L,则:
CO(g)+$\frac{1}{2}$ O2(g)?CO2(g)
起始(mol/L):1.0×10-5 1.0×10-4
变化(mol/L):x x
平衡(mol/L):1.0×10-5 -x 1.0×10-4 1.0×10-4+x
则$\frac{(1×1{0}^{-4}+x)}{(1×1{0}^{-5}-x)×(1×1{0}^{-4})^{\frac{1}{2}}}$=104,解得x=8.91×10-6mol/L,
故平衡时CO浓度为1.0×10-5mol-8.91×10-6mol=1.1×10-6mol/L
故答案为:1.1×10-6;
(3)等体积混合后溶液中碳酸根的浓度为2×l0-4mol/L÷2=1×l0-4mol/L,要生成CaCO3沉淀需要钙离子浓度为$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×l0-5mol/L,故需要CaCl2溶液的最小浓度为2.8×l0-5mol/L×2=5.6×l0-5mol/L,
故答案为:5.6×10-5.
点评 本题属于拼合型题目,涉及化学反应速率计算、化学平衡移动、平衡常数应用、溶度积计算,难度中等,(3)中注意等体积混合后碳酸根的浓度变化情况.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
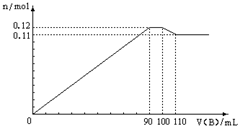 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
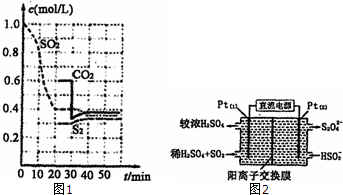 硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量氢氧化钠溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4 gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl->F->Na+ | B. | 热稳定性:HCl>H2S>HF | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 熔点:金刚石>晶体硅>CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com