
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ |
| C、氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |


科目:高中化学 来源: 题型:
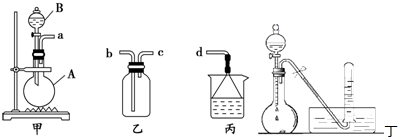
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔质量:g?mol-1 |
| B、密度:g?mL-1 |
| C、气体摩尔体积:L |
| D、阿伏加德罗常数:mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
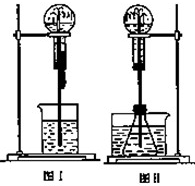 喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.
喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离常数(25℃) |
| HF: Ka1=3.6×10-4 |
| H3PO4: Ka1=7.5×10-3 Ka2=6.2×10-8 Ka3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-→H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:PO43->F->HPO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
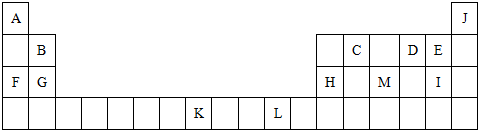
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com