
分析 (1)先根据n=$\frac{m}{M}$计算出45.6mgMg2+的物质的量,然后根据物质的量浓度计算公式:c=$\frac{n}{V}$,计算出Mg2+的物质的量浓度;
(2)根据n(KCl):n(CaCl2)=n(K+):n(Ca2+)计算物质的量之比,根据m=nM计算质量关系,进而计算质量分数.
解答 解:(1)1.0L该矿泉水中含有45.6mgMg2+,含有的镁离子的物质的量为:n(Mg2+)=$\frac{0.0456g}{24g/mol}$=0.0019mol,
镁离子的物质的量浓度为:c(Mg2+)=$\frac{0.0019mol}{1.0L}$=1.9×10-3mol/L,
故答案为:1.9×10-3mol/L;
(2)由KCl与CaCl2的化学式可知:n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:1,
设KCl为2mol,则CaCl2为1mol,
则m(KCl)=2mol×74.5g/mol=149g,m(CaCl2)=1mol×111g/mol=111g,
所以:该混合物中的CaCl2的质量分数为:$\frac{111g}{111g+149g}$=42.7%,
故答案为:2:1;42.7%.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意熟练掌握物质的量与物质的量浓度、摩尔质量的计算公式,试题贴近高考,针对性强,有利于培养学生的分析能力及化学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol•L-1•min-1 | B. | vB=0.3mol•L-1•min-1 | ||
| C. | vC=0.8mol•L-1•min-1 | D. | vD=1mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )| A. | 该电池的反应方程式为I2+2Ag═2AgI | |
| B. | 石墨电极为正极,银电极为负极 | |
| C. | 正极的电极反应是:Ag-e-═Ag+ | |
| D. | 装置中电子移动的途径是:银电极→导线→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在周期表中,主族元素的主族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强 | |
| C. | 同主族元素随着原子的核电荷数的递增,原子半径依次增大 | |
| D. | 主族元素的单质,随相对分子质量的增大,熔、沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH2CH3 | B. | (CH3)2CHCH=CH2 | C. | CH2=CH-CH=CH2 | D. | 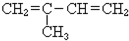 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 和
和 .甲烷和庚烷
.甲烷和庚烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g白磷晶体中含有的P-P键数是0.4NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焦炭还原法 | B. | 湿法炼铜 | C. | 铝热还原法 | D. | 电解冶炼法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com