
【题目】已知部分弱酸的电离常数如下表:

下列叙述正确的是
A. 氢氟酸与NaClO溶液混合能够发生反应:HF+NaClO=HClO+NaF
B. 物质的量浓度相同的①NaF②Na2CO3③NaClO三种溶液的pH:③>②>①
C. Na2CO3溶液不能与次氯酸发生反应
D. 少量CO2通入NaClO溶液中的离子反应:CO2+H2O+2ClO-= CO32-+2HClO
【答案】A
【解析】
A项,由于氢氟酸的电离平衡常数大于次氯酸的电离平衡常数,说明氢氟酸的酸性强于次氯酸,所以氢氟酸可以和次氯酸钠反应生成次氯酸,故A项正确;
B项,酸性越强,电离平衡常数越大,对应酸根离子的水解程度越弱,对应等物质的量的盐溶液的pH越小,酸性HF>HClO>HCO3-,所以物质的量浓度相同的三种溶液的pH:②>③>①,故B项错误;
C项,碳酸氢根离子的电离平衡常数小于次氯酸根的电离平衡常数,所以碳酸钠能与次氯酸反应,故C项错误;
D项,由电离平衡常数可知,酸性:H2CO3>HClO >HCO3-,所以少量CO2通入NaClO 溶液中的离子反应:CO2+H2O+ClO-= HCO3-+HClO,故D项错误;
故答案选A。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
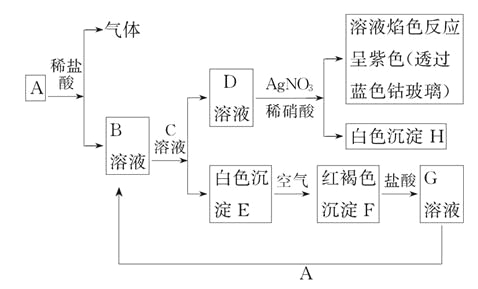
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
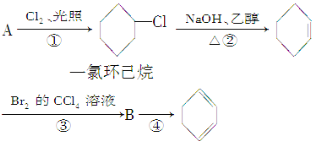
(1)A的结构简式是______,名称是______。
(2)①的反应类型是______,②的反应类型是______。
(3)反应④的化学方程式是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型锂空气二次电池放电情况如图所示,关于该电池的叙述正确的是
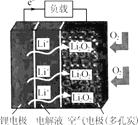
A.电解液应选择可传递Li+的水溶液
B.充电时,应将锂电极与电源正极相连
C.放电时,空气电极上发生的电极反应为 2Li++O2+2e-=Li2O2
D.充电时,若电路中转移0.5mol电子,空气电极的质量将减少3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)8.5g氢氧根离子含有的电子数目为_______。
(2)3.1gNa2X含有Na0.1mol,则Na2X的摩尔质量为______,X的相对原子质量为_______。
(3)若1gCO2中含有x个原子,则阿伏加德罗常数可表示为_______。
(4)由硫酸钾、 硫酸铁和硫酸组成的混合溶液,其中c(H)0.1mol/L,c(Fe3)0.3mol/L,c(SO42)0.6mol/L,则c(K)为_______。
(5)相同物质的质量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1时,消耗三种盐溶液的体积比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:

已知:![]() ,根据以上的实验操作和现象,该同学得出的结论不正确的是
,根据以上的实验操作和现象,该同学得出的结论不正确的是![]()
A.试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]()
B.试样中一定不含![]()
C.试样中可能存在![]() 、
、![]()
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
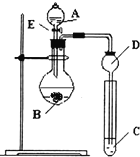
(1)图中D装置名称是______.
(2)N、C、Si的非金属性由强到弱的顺序是:______;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为______;试剂C为______(填序号).
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
(3)①乙同学设计的实验所用到试剂A为______;试剂B为______;试剂C为______.(写名称)
②写出C中发生反应的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰) Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com