
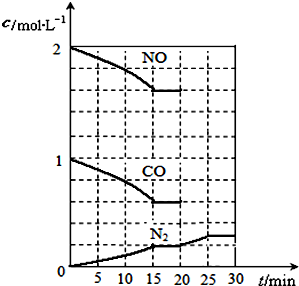
 二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| 0.2×0.42 |
| 0.62×1.62 |
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| 0.2×0.42 |
| 1.22×1.62 |
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| 0.8×0.42 |
| 1.22×1.62 |


科目:高中化学 来源: 题型:
| A、1mol苯分子中含有C=C双键数为3NA | ||
| B、1mol甲基(-CH3)所含的电子总数为10NA | ||
C、标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为
| ||
| D、4.2g乙烯和丙烯的混合气体中所含碳原子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯离子结构示意图: | ||
B、NH4Cl的电子式: | ||
C、质子数为55,中子数为82的铯原子:
| ||
| D、HClO的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、豆科植物根瘤菌将含氮化合物转变为植物蛋白质 |
| B、植物从土壤中吸收含氮养料 |
| C、将空气中的氮气转变为含氮化合物 |
| D、将氨转变成硝酸及其它氮的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com