
����Ŀ����������һ����Ҫ�Ļ����м��壬������ҵ�о����ȵ㡣һ���Ը����̿�(��Ҫ�ɷ�Ϊ���̻����PFeS)Ϊԭ���Ʊ������̵Ĺ����������£�
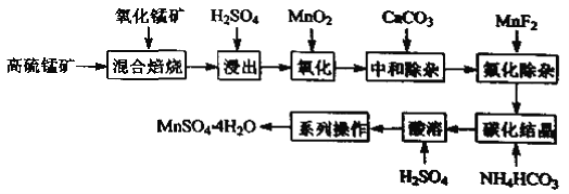
��֪��������ϱ�������������MnSO4��Fe2O3������FeO��Al2O3��MgO��
�ڽ���������ˮ��Һ�е�ƽ��Ũ����pH�Ĺ�ϵ��ͼ��ʾ(25��)��
�۴�ʵ��������Mn2+��ʼ������pHΪ7.54��������Ũ����105mol��L1ʱ������Ϊ���ӳ�����ȫ��
��ش�
��1����ͳ���մ��������̿�ʱ����������ϱ�����������ֱ����H2SO4��������ȱ��Ϊ____��
��2����������ʱ��������Ӧ�����ӷ���ʽΪ____����ʡ�������������裬��ɵĺ����____��
��3�����кͳ�����ʱ�����ɳ�������Ҫ�ɷ�Ϊ____(�ѧʽ)��
��4��������������ʱ����ʹ��Һ�е�Mg2+��Ca2+������ȫ����ά��c(F-)������____��(��֪��Ksp(MgF2)=6.4��1010��Ksp(CaF2)=3.6��1012)
��5����̼���ᾧ��ʱ��������Ӧ�����ӷ���ʽΪ_____��
��6���ö��Ե缫���MnSO4��Һ���Ʊ�MnO2���������������ĵ缫��ӦʽΪ____��
���𰸡�������������壬��Ⱦ���� MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O Fe2+��Mn2+���������ص������Mn2+��ʧ(��Fe2+ȥ������ȫ,Ӱ���Ʒ����) Fe(OH)3��Al(OH)3 8��103mol��L1 Mn2++2HCO3-=MnCO3��+CO2��+H2O Mn2++2H2O2e=MnO2+4H+
��������
�����̿���Ҫ�ɷ�Ϊ���̻����PFeS���������̿��ϱ��գ��õ�MnSO4��Fe2O3������FeO��Al2O3��MgO���������ᣬ�õ�Mn2+��Fe2+��Fe3+��Mg2+��Al3+��������Һ������������̽�������������Ϊ�����ӱ��ڳ�ȥ���ټ���̼����кͣ������������������������������ʽ��ȥ������MnF2���ӣ�ʹ��Һ�е�Mg2+������ȫ����ʱ��Һ�еĽ�������Ϊ�����ӣ�����̼��立���Mn2++2HCO3-=MnCO3��+CO2��+H2O�����������ܽ������̣���������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ������̵�ˮ����ݴ˷�����
��1�����̿���FeS����ͳ���մ��������̿�ʱ����������ϱ�����������ֱ����H2SO4������������������壬��Ⱦ�������ʴ�Ϊ��������������壬��Ⱦ������
��2������ʱ�ö������������������ӣ����ӷ���ʽΪ��MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O����ʡ�������������裬����ͼ��Fe2+��Mn2+���������ص������Mn2+��ʧ(��Fe2+ȥ������ȫ��Ӱ���Ʒ����)���ʴ�Ϊ��MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O��Fe2+��Mn2+���������ص������Mn2+��ʧ(��Fe2+ȥ������ȫ,Ӱ���Ʒ����)��
��3�����кͳ�����ʱ����������������������̼�������֮�䷢��˫ˮ�ⷴӦ�õ�Fe(OH)3��Al(OH)3�������ʴ�Ϊ��Fe(OH)3��Al(OH)3��
��4����֪��Ksp(MgF2)=6.4��1010����ʹ��Һ�е�Mg2+������ȫ����ά��c(F)������![]() ���ʴ�Ϊ��8��103mol��L1��
���ʴ�Ϊ��8��103mol��L1��
��5����̼���ᾧ��ʱ��������Ӧ�����ӷ���ʽΪ��Mn2++2HCO3-=MnCO3��+CO2��+H2O��
�ʴ�Ϊ��Mn2++2HCO3-=MnCO3��+CO2��+H2O��
��6���ö��Ե缫���MnSO4��Һ���Ʊ�MnO2������������������������Ӧ��Ԫ�ػ��ϼ����ߣ���Ϊ������ʧȥ�������ɶ������̣��缫��ӦʽΪ��Mn2++2H2O2e=MnO2+4H+���ʴ�Ϊ��Mn2++2H2O2e=MnO2+4H+��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ͭ��Ĵ����ȽϷḻ����Ҫ���ؼ����ڳ��������ε��������������ɽ���ϲ�������ĺ��������Լ����ظ�ԭ�ȵء���ͭ����һ��ͭ����������ۻ�ͭɫ����Ҫ�ɷ���CuFeS2��������������SiO2��Ni��Pb��Ag��Au��Ԫ�ء�Ϊʵ�ֻ�ͭ����ۺ����ã���������µĹ������̡�
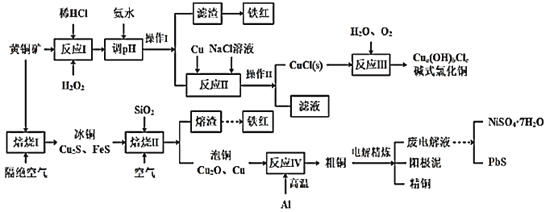
��֪����a��b��c��Ϊ��������CuCl+2Cl-![]() CuCl32-��
CuCl32-��
��1��CuFeS2��S�Ļ��ϼ�Ϊ___���������Ҫ�ɷ���___(�ѧʽ)��
��2��ʵ��������ӦI������SO42-���ɣ��÷�Ӧ���ӷ���ʽΪ___��ѡH2O2��Һ����HNO3��ԭ����___��
��3������ӦII����NaClŨ�ȹ���ʽ�Ȼ�ͭ���ʽϵͣ���ԭ����____��
��4��д��������I��������Ӧ�Ļ�ѧ����ʽ___��
��5���ϵ��Һ�к���������Pb2+���ӷϵ��Һ�г�ȥPb2+�ķ�����������ͨ��H2S�����ͣ�ʹPb2+ת��Ϊ������������ϵ��Һ��pH=4��Ϊ��֤������NiS������Ni2+Ũ��Ӧ������___���¡�(��֪������H2S��Һ��c(H2S)Ϊ0.1mol/L��H2S�ĵ��볣��Ka1=1.0��10-7��Ka2=2.0��10-15��Ksp(NiS)=1.4��10-16)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ������Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.����AgCl��AgI���������Һ��c(Ag+)>c(C1-)=c(I-)
B.pH=1��NaHSO4��Һ��c(H+)=c(SO42-)+c(OH-)
C.�����£�0.1molL-1�Ģ�NH4Cl��CH3COONH4��NH4HSO4��Һ�У�c(NH4+)��С˳��>��>��
D.���ʵ���Ũ��֮��Ϊ1��2��NaClO��NaHCO3�����Һ�У�c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������Ӧ�ù㷺��ij�����Ի�����(��Ҫ�ɷ�ΪFeS2)Ϊԭ�ϣ����ýӴ����Ʊ����ᡣ
(1)��֪��298 K��101 kPa�����£�
FeS2(s)=FeS(s)+S(s) H1
S(s)+ O2(g)=SO2(g) H2
4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) H3
���ڸ�������FeS2��O2����Fe2O3��SO2���Ȼ�ѧ����ʽΪ_______��
(2)��������Ӧ��2SO2(g) +O2(g)![]() 2SO3(g) H<0��������ɱ���ܱ������У�ά��ѹǿΪ101 kPa�ͳ�ʼn(SO2)=2mol������һ������O2��SO2��ƽ��ת������(SO2)��O2���ʵ���n(O2)�ı仯��ϵ��ͼ��ʾ��
2SO3(g) H<0��������ɱ���ܱ������У�ά��ѹǿΪ101 kPa�ͳ�ʼn(SO2)=2mol������һ������O2��SO2��ƽ��ת������(SO2)��O2���ʵ���n(O2)�ı仯��ϵ��ͼ��ʾ��
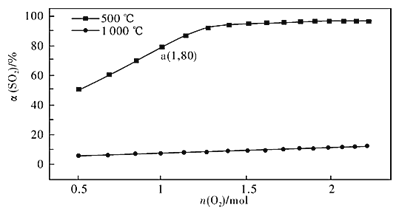
����1000��ʱ��SO2ƽ��ת��������O2���ʵ��������������ߣ�������ԭ��________��
��a��ʱSO3��ƽ���ѹp(SO3)=_________Pa(������λ��Ч���֣�ij��ֵ�ƽ���ѹ=��ѹ��ij��ֵ����ʵ�������)��
(3)�����¶Ȳ��䣬��̶�������ܱ������г���һ������SO2��O2���뻭��ƽ����ϵ��SO3�����������(SO3)���ʼSO2��O2�����ʵ���֮��[n(SO2)/n(O2)]�ı仯����ͼ______��
(4)��֪����������SO2��������ΪSO3�����ݼ����ģ��������̿�ڱ�����O2ת��Ϊ�������ķ�Ӧ�����������仯��ϵ��ͼ��ʾ������˵������ȷ����_______(����ĸ����)��
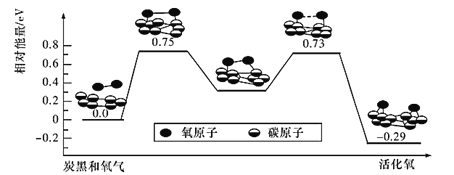
A.O2ת��Ϊ���������������Ķ�����̼���������ɹ���
B.�ù��̵��������(���)E��=0.73 eV
C.ÿ�һ��O2������������0. 29 eV����
D.����̿�ڿ�����ΪSO2ת��ΪSO3�Ĵ���
E.����������ͬʱ��̿�ڿ���ԽС����Ӧ����Խ��
(5)���Ṥ��β���е�SO2�ɱ�NaOH��Һ���գ��ö��Ե缫�����õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4��д�������ĵ缫��Ӧʽ��___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����298K��100kPaʱ��
��C(s��ʯī)��O2(g)=CO2(g) ��H1=��393.5kJ��mol��1��
��2H2(g)��O2(g)=2H2O(l) ��H2=��571.6kJ��mol��1��
��2C2H2(g)��5O2(g)=4CO2(g)+ 2H2O(l) ��H3=��2599kJ��mol��1��
��Ӧ2C(s��ʯī)+H2(g)=C2H2(g)�ķ�Ӧ�ȡ�HΪ�� ��
A.-237.46kJ��mol-1B.+226.7kJ��mol-1
C.-226.7kJ��mol-1D.+237.46kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϳ�1��2�����������ʵ��װ����ͼ��ʾ������˵���в���ȷ���ǣ� ��
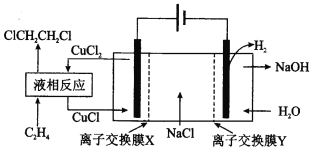
A.��װ�ù���ʱ����������Һ�е�����Ũ�Ȳ�������
B.Һ�෴Ӧ�У�C2H4��CuCl2����Ϊ1��2����������
C.X��Y����Ϊ�����ӽ���Ĥ�������ӽ���Ĥ
D.��װ���ܷ�ӦΪCH2=CH2+2H2O+2NaCl![]() H2��+2NaOH+ClCH2CH2Cl
H2��+2NaOH+ClCH2CH2Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��1mol/L��HA��1mol/L��HB��������Һ����ʼʱ�������ΪV0���ֱ�������Һ�м�ˮ����ϡ�ͣ����ñ仯��ϵ��ͼ��ʾ��V��ʾ��Һϡ�ͺ�������������˵���������
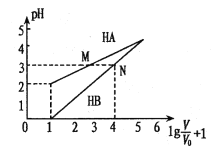
A. Ka( HA)ԼΪ10-4
B. ������Һ��ϡ����![]() ʱ����Һ��
ʱ����Һ��![]() ��
��![]()
C. �к͵����pH��ͬ������������n(NaOH)��HA>HB
D. ������������ʵ���Ũ�ȵ�NaA��NaB��Һ����������ǰ��С�ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������к�������![]() ��������������Է�������Ϊ136����������ת�����ش�������⡣
��������������Է�������Ϊ136����������ת�����ش�������⡣
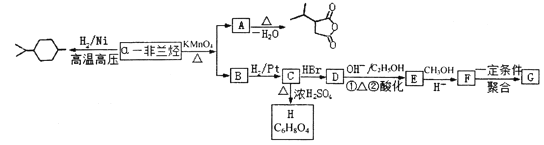
��֪��a.![]()
b.![]()
c.2CH3COOH![]()
(1)![]() ���������Ľṹ��ʽΪ_________________��
���������Ľṹ��ʽΪ_________________��
(2)B�к��еĹ���������Ϊ__________��C��D�ķ�Ӧ����Ϊ________________��
(3)C��H�ķ�Ӧ����ʽΪ_________________________________��
(4)д��������������A��ͬ���칹��__________(д���ּ���)��
�ٺ���4����CH3��1mol��ͬ���칹���ڼ���������ˮ����2mol NaOH��
(5)��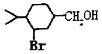 Ϊԭ�Ϻϳ�
Ϊԭ�Ϻϳ�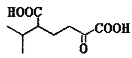 ��_____________(������ͼ��ʾ���������Լ���ѡ)
��_____________(������ͼ��ʾ���������Լ���ѡ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ⱦ����Դ��ȱ��������ͻ������Դ��ѭ��������Ϊ��Ҫ����ҵ �����ú� Cu2O�������� Al2O3��Fe2O3 �� SiO2���Ŀ�����ȡͭ�Ĺ����������£�

��֪����Cu2O ��������������ת���ɵ��� Cu �ͺ� Cu2+����Һ��
�ڼ��������������ʱ�� pH ���±���
�������� | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
����ʱ�� pH | 4.0~5.2 | 5.8~8.8 | 1.1~3.2 | 5.4~6.7 |
�ش��������⣺
��1���������� A ���еijɷ�Ϊ Cu ����һ�����ʣ��ӹ��� A �з���� Cu �Ŀ� ���Լ�Ϊ_____��Һ���ѧʽ����
��2����������������ˡ�ϴ�Ӻ���Ԫ�ص���Ҫ������ʽΪ__________�����ӷ��ţ�����������ӵij��û�ѧ�Լ���_________________��
��3���� NaClO ������������Һ�� pH Ϊ_____���õ����� B ��һ�־���Ư�� �Ե����� D���÷�Ӧ���ӷ���ʽΪ_________��
��4��25��ʱ���� NaOH ���������Һ pH �õ� Al(OH)3 �������� pH=5.3 ʱ������ ��Һ�� c(Al3+)=_____����֪ 25��ʱ Ksp[Al(OH)3]=1.3��10-33��
��5���ö��Ե缫����ý���ͭʱ����ʼ������������������������ʵ���֮��Ϊ___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com