
【题目】(1)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:甲醇的燃烧热486为kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H b =-566.0 kJ·mol-1
试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(l)的热化学方程式:______________。
(2)常温下某溶液中由水电离的c(H+)=10-10 mol/L,则该溶液的pH为 _________。
(3)常温下,向VLpH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+恰好沉淀完全时,溶液pH=11。则Ba(OH)2溶液与NaHSO4溶液的体积比为__________,NaHSO4溶液的物质的量浓度为____________。
(4)常温下,0.5mol/L的NH4Cl溶液的为pH=5.该溶液显酸性的原因是(用离子方程式表示)____________。计算常温下氨水的电离平衡常数为________________。
【答案】 2CH3OH+ 3O2(g) = 2CO(g) + 4H2O △H = -1538kJ/mol 4或10 1∶4 0.00125mol/L NH4+ + H2O NH3·H2O + H+ 5 ×10-5
【解析】(1)已知①CH3OH(1)+O2(g)=CO(g)+2H2O(l) △Ha=-486kJmol-1
②2CO(g)+O2(g)=2CO2(g) △Hb=-566.0kJmol-1;
CH3OH(1)在氧气中完全燃烧生成CO2和H2O(l)的反应:2CH3OH(l)+3O2(g)═2CO2(l)+4H2O(l)可以是①×2+②得到,所以2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=2△Ha+△Hb=2(-486kJmol-1)+(-566.0kJmol-1)=-1538kJmol-1,即2CH3OH(l)+ 3O2(g) = 2CO(g) + 4H2O(l) △H = -1538kJ/mol;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离,常温下,kw=c(H+)×c(OH-)=1×10-14,纯水中c(H+)=1×10-7molL-1,该溶液中由水电离产生的c(OH-)=1×10-10molL-1<1×10-7molL-1,说明该溶液抑制水电离,所以该溶液可能是酸也可能是碱,如果是酸溶液,则溶液中氢离子浓度是0.01mol/L,溶液的pH=2,如果是碱溶液,则溶液中氢原子浓度是1×10-10molL-1,溶液的pH=10;
(3)VL pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,含有的氢氧根离子物质的量为V×10-2mol=0.01Vmol,溶液中的Ba2+恰好完全沉淀时反应的硫酸氢钠物质的量为0.5V×10-2mol=0.005Vmol,设硫酸氢钠溶液体积为x,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:c(OH-)=10-3mol/L,则: ![]() =10-3,解得:x=4VL,则Ba(OH)2溶液与NaHSO4溶液的体积比为VL:4VL=1:4;该硫酸氢钠溶液的浓度为:
=10-3,解得:x=4VL,则Ba(OH)2溶液与NaHSO4溶液的体积比为VL:4VL=1:4;该硫酸氢钠溶液的浓度为: ![]() =1.25×10-3molL-1;
=1.25×10-3molL-1;
(4)常温下,0.5mol/L的NH4Cl溶液的为pH=5,即c(H+)=10-5mol/L,氯化铵溶液显酸性的原因是铵根离子发生水解:NH4++H2O![]() NH3H2O+H+;已知NH3H2O
NH3H2O+H+;已知NH3H2O![]() NH4++OH-,Ka=[c(NH4+)c(OH-)]/c(NH3H2O)=[c(NH4+)c(OH-)c(H+)]/[c(H+)c(NH3H2O)]=[Kwc(NH4+)]/[c2(H+)]=[1×10-14×0.5mol/L]/(1×10-5mol/L)2
NH4++OH-,Ka=[c(NH4+)c(OH-)]/c(NH3H2O)=[c(NH4+)c(OH-)c(H+)]/[c(H+)c(NH3H2O)]=[Kwc(NH4+)]/[c2(H+)]=[1×10-14×0.5mol/L]/(1×10-5mol/L)2
=5×10-5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列分类不正确的是( )
A.纯碱、烧碱均属于碱类
B.CO2、SiO2、SO2均属于酸性氧化物
C.醋酸、硫酸、硝酸均属于酸类
D.Na2CO3、Na2SO3、NaCl均属于钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒沙特列原理解释的是 ( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g) ![]() N2O4 (g))
N2O4 (g))
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.用硫酸氢钠去除暖水瓶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
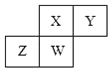
A. 原子半径:Z>W>X>Y
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. ZY2晶体熔化、液态Y3气化均需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某磁流体的分散质粒子直径在5.5~36nm之间.下列说法正确的是( )
A.此磁流体是溶液
B.此磁流体是悬浊液
C.此磁流体很不稳定
D.当一束强光通过此磁流体时会出现光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为![]()
D.它与水反应的离子方程式为NH4++H﹣+H2O=NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是

A.HCl溶液滴加一半时,溶液pH>7
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol·L—1
C.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+2c(CO32—)+c(HCO3—)
D.在M点:c(Na+)>c(CO32—)=c(HCO3—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.浊液的分散质粒子直径大于l00nm,不能通过滤纸
B.胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸
C.利用丁达尔效应可以区分溶液和胶体
D.将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com