
【题目】写出下列四个反应的方程式:
(1)铁和水蒸气的反应___________(写出化学方程式)。
(2)过氧化钠和二氧化碳的反应___________(写出化学方程式)。
(3)铝和氢氧化钠溶液的反应___________(写出离子方程式)。
(4)氧化铝与氢氧化钠反应_____________(写出离子方程式)。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 2Na2O2+2CO2=2Na2CO3+O2 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2OH-= 2AlO2-+H2O
Fe3O4+4H2 2Na2O2+2CO2=2Na2CO3+O2 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2OH-= 2AlO2-+H2O
【解析】
(1)Fe与水蒸气在高温下反应产生四氧化三铁和氢气;
(2)过氧化钠和二氧化碳反应产生碳酸钠和氧气;
(3)铝和氢氧化钠溶液的反应产生偏铝酸钠和氢气;
(4)氧化铝与氢氧化钠溶液反应产生偏铝酸钠和水。
(1)Fe与水蒸气在高温下反应产生四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)过氧化钠和二氧化碳反应产生碳酸钠和氧气,反应的化学方程式为:
2Na2O2+2CO2=2Na2CO3+O2;
(3)铝和氢氧化钠溶液的反应产生偏铝酸钠和氢气,反应的离子方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)氧化铝与氢氧化钠溶液反应产生偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-= 2AlO2-+H2O。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,3.4 g NH3中含有的电子数为0.2NA
B.1 mol·L-1的Fe2(SO4)3溶液中,含有的SO42-数目为3NA
C.标准状况下,22.4 L CO2和O2的混合气体中含氧原子数为2NA
D.1 mol Fe在纯氧中完全燃烧,生成Fe3O4,Fe失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
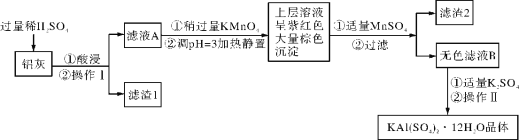
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中铁元素被还原的是( )
A.2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
B.Fe+CuSO4=Cu+FeSO4
C.Fe(OH)3+3HCl=FeCl3+3H2O
D.2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,X在周期表中原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。各物质之间的转化关系如图,部分生成物省略。

请回答下列问题:
(1)写出Z在周期表中的位置____,D的结构式____。
(2)写出A的化学式____。
(3)写出反应①的离子方程式____。
(4)为了获得氯化铜晶体,需要将B溶液在HCl氛围中蒸发结晶,原因是____。
(5)将F溶于稀硝酸,溶液变成蓝色,并放出无色气体。写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1∶2的是( )
A. 3S+6NaOH===2Na2S+Na2SO3+3H2O
B. 2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
C. 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. I2+2NaClO3===2NaIO3+Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
②N2(g)+O2(g)![]() 2NO(g) ΔH2
2NO(g) ΔH2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
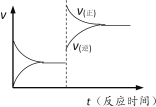
下列说法正确的是
A. 反应①使用催化剂,ΔH1减小
B. 反应②生成物总能量低于反应物总能量
C. 反应③一定能自发进行
D. 反应③达到平衡后升高温度,v(正)、v(逆)的变化如右图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B.标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C.0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
D.加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与16gO2所含原子总数相同的NH3标准状况下体积是________L;
(2)已知2L Al2(SO4)3溶液中c(Al3+)=3mol/L,它与3L__________mol/LNa2SO4中SO42-的物质的量浓度相等。
(3)同温同压下:同体积的NH3和H2S气体的质量比为_____________;同质量的NH3和H2S气体的体积比为___________,其中含有的氢的原子个数比为________;若NH3和H2S中的氢原子数相等,它们的体积比为____________。
(4)在标准状况下,8.96L的CH4和CO的混合气体,混合气体对氢气相对密度是9.5,则混合气体中CH4的体积为____________,CH4和CO原子个数比为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com