
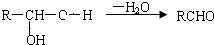
 ,E
,E .
. .
.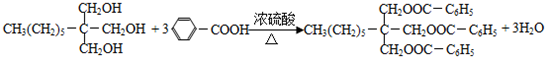 .
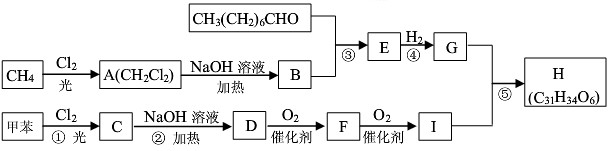
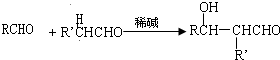
. 分析 甲烷和氯气在光照条件下发生取代反应生成A,根据题给信息知A为CH2Cl2,A和氢氧化钠的水溶液发生取代反应生成,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则B的结构简式为HCHO,CH3(CH2)6CHO和甲醛反应生成E,根据题给信息知,E的结构简式为 ,E和氢气发生加成反应生成G,则G的结构简式为CH3(CH2)5C(CH2OH)3,甲苯在光照条件下与氯气发生取代反应,C是一氯甲苯,其结构简式为
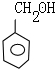
,E和氢气发生加成反应生成G,则G的结构简式为CH3(CH2)5C(CH2OH)3,甲苯在光照条件下与氯气发生取代反应,C是一氯甲苯,其结构简式为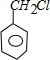 ,
, 和氢氧化钠的水溶液发生取代反应生成D,D的结构简式为
和氢氧化钠的水溶液发生取代反应生成D,D的结构简式为 ,D被氧化生成F苯甲醛,则F的结构简式为
,D被氧化生成F苯甲醛,则F的结构简式为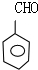 ,苯甲醛被氧化生成I,I的结构简式为
,苯甲醛被氧化生成I,I的结构简式为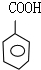 ,G和I反应生成H,H的结构简式为
,G和I反应生成H,H的结构简式为 ,据此分析解答,
,据此分析解答,
解答 解:甲烷和氯气在光照条件下发生取代反应生成A,根据题给信息知A为CH2Cl2,A和氢氧化钠的水溶液发生取代反应生成,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则B的结构简式为HCHO,CH3(CH2)6CHO和甲醛反应生成E,根据题给信息知,E的结构简式为 ,E和氢气发生加成反应生成G,则G的结构简式为CH3(CH2)5C(CH2OH)3,甲苯在光照条件下与氯气发生取代反应,C是一氯甲苯,其结构简式为
,E和氢气发生加成反应生成G,则G的结构简式为CH3(CH2)5C(CH2OH)3,甲苯在光照条件下与氯气发生取代反应,C是一氯甲苯,其结构简式为 ,
, 和氢氧化钠的水溶液发生取代反应生成D,D的结构简式为
和氢氧化钠的水溶液发生取代反应生成D,D的结构简式为 ,D被氧化生成F苯甲醛,则F的结构简式为
,D被氧化生成F苯甲醛,则F的结构简式为 ,苯甲醛被氧化生成I,I的结构简式为
,苯甲醛被氧化生成I,I的结构简式为 ,G和I反应生成H,H的结构简式为
,G和I反应生成H,H的结构简式为 .
.
(1)通过以上分析知,D、E结构简式分别为 、
、 ,
,
故答案为: ;
;  ;
;
(2)B为HCHO,官能团为醛基,反应⑤的反应类型为取代反应,
故答案为:醛基; 取代反应;
(3)CH3(CH2)6CHO的同分异构体符合下列要求,
A.能发生银镜反应,说明含有醛基;
B.烃基上的一氯取代物只有两种,证明烃基上只有两种氢原子,
则符合条件的同分异构体结构简式为(CH3CH2)3CCHO、(CH3)3CC(CH3)2CHO,
故答案为:(CH3CH2)3CCHO、(CH3)3CC(CH3)2CHO;
(4)F是苯甲醛,I是苯甲酸,苯甲醛中含有醛基,苯甲酸中含有羧基,醛能和银氨溶液发生银镜反应,能和新制氢氧化铜悬浊液反应生成红色沉淀,酸具有酸的通性,能使紫色石蕊试纸变蓝色,所以鉴别方法是:把F和I配成溶液,分别滴加紫色石蕊试液,如变红的是苯甲酸(即I),不变色的是苯甲醛(即F),或者是蓝色石蕊试纸、银镜反应、新制氢氧化铜悬浊液等,
故答案为:把F和I配成溶液,分别滴加紫色石蕊试液,如变红的是苯甲酸(即I),不变色的是苯甲醛(即F)或者是蓝色石蕊试纸、银镜反应、新制氢氧化铜悬浊液等;
(5)反应②是一氯甲苯在强碱溶液中发生的水解反应生成苯甲醇,反应的化学方程式为 ,
,
故答案为: ;
;
(6)反应⑤是苯甲酸和含三个醇羟基的E在浓硫酸加热条件下发生的酯化反应,化学方程式为 ,
,
故答案为:
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及信息迁移能力,明确常见有机物官能团的性质、物质之间的转化、题给信息的灵活运用是解本题关键,注意:同一个碳原子上不能含有两个羟基,易失水生成醛基,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 同时含有分子和离子的电解质溶液,一定是弱电解质溶液 | |
| B. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
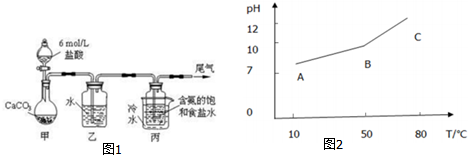
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
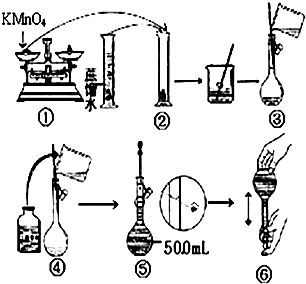 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
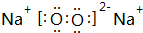 (用电子式表示)
(用电子式表示)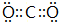 (用电子式表示)
(用电子式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com