
【题目】I.氢化钠(NaH) 是一种离子化合物,遇水后放出氢气并生成一种碱,主要应用在有机合成和储氢材料方面。根据信息完成下列各空:
(1)氢化钠的电子式为_____________________________。
(2)氢化钠与水反应的化学方程式为_____________________,反应的氧化剂为___________。该反应过程中,被破坏的化学键有_____________(填序号,下同),形成的化学键有______________。
①离子键 ②极性共价键 ③非极性共价键
II.现有短周期元素X 形成的单质A与NaOH溶液反应,有如下转化关系: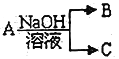 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)常温常压下,若A 为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为________________________________________________;
(2)若A 为金属单质,C 为气体,则A 与NaOH 溶液反应的离子方程式为_____________________________;A 最高价氧化物的水化物与NaOH 溶液反应的离子方程式为______________________________。
【答案】 ![]() NaH+H2O=NaOH+H2↑ 水(或H2O) ①② ③ 2C+SiO2
NaH+H2O=NaOH+H2↑ 水(或H2O) ①② ③ 2C+SiO2![]() 2CO↑+Si 2Al+2OH-+2H2O=2AlO2-+3H2↑ Al(OH)3+OH-=AlO2-+2H2O
2CO↑+Si 2Al+2OH-+2H2O=2AlO2-+3H2↑ Al(OH)3+OH-=AlO2-+2H2O
【解析】I.(1)NaH是由钠离子和氢负离子组成,为离子化合物,两种离子最外层均达到8电子和2电子稳定结构,电子式为![]() ;正确答案:
;正确答案:![]() 。
。
(2)氢化钠与水反应生成氢氧化钠和氢气,化学方程式为NaH+H2O=NaOH+H2↑;NaH中H由-1价升高到0价,发生氧化反应,做还原剂;H2O中H由+1价降低到0价,发生还原反应,做氧化剂;NaH中的离子键破坏,H2O中的极性共价键被破坏;①②正确;反应生成了NaOH,形成了钠离子与氢氧根离子之间的离子键和氢原子与氧原子间的极性共价键,氢气分子中的非极性共价键;③正确;正确答案:水(或H2O);①②; ③。
II.(1)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则A是硅,工业制取单质硅的化学方程式为2C+SiO2![]() 2CO↑+Si;正确答案:2C+SiO2
2CO↑+Si;正确答案:2C+SiO2![]() 2CO↑+Si。
2CO↑+Si。
(2)若A为金属,C为气体,则A是铝,铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑ ; 铝的最高价氧化物的水化物氢氧化铝与NaOH溶液反应的生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O;正确答案:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al(OH)3+OH-=AlO2-+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验操作错误的是( )
A.用燃着的酒精灯去点燃另一个酒精灯
B.用托盘天平称量固体的质量时,砝码放在右盘
C.给试管里的固体加热时,试管口略向下倾斜
D.给烧瓶里的液体加热时,垫上石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,b和c为两种常见的金属元素,a、b、c、d的最高价氧化物对应的水化物依次为甲、乙、丙、丁,它们之间存在如图所示的反应关系(图中用“--“相连的两种物质间能发生反应)。下列判断一定正确的是
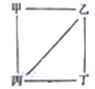
A. 简单离子半径:d>b>c>a
B. 等物质的量的ba3、b3a所含离子总数不相等
C. d的最高化合价和最低化合价的代数和为6
D. b和d组成的化合物的水溶液是中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马铃薯有望成为水稻、小麦、玉米之后的我国第四大主粮作物.马铃薯约含20%淀粉,淀粉属于(填“糖类”或“油脂”). 医疗上常用作“钡餐”的是(填“硫酸钡”或“碳酸钡”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y电极附近观察到的现象;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出).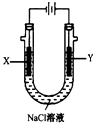
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。____________
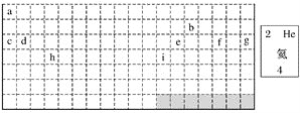
(2)表中所列元素,属于短周期元素的有________,属于主族元素的有________。
(3)g元素位于第________周期第________族;i元素位于第________周期第________族。
(4)元素f是第________周期第________族元素,请按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4s时c(B)为0.78 mol/L
B. 该反应AH>0
C. 830℃达平衡时,A的转化率为20%
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为2.5
A(g)+B(g)的平衡常数为2.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com