
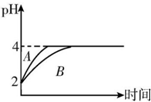
 ��֪t��ʱ��0.01mol•L-1NaOH��Һ��pH=11��0.1mol•L-1��HA��Һ��$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=109����ش��������⣺
��֪t��ʱ��0.01mol•L-1NaOH��Һ��pH=11��0.1mol•L-1��HA��Һ��$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=109����ش��������⣺���� ��1��0.01mol•L-1NaOH��Һ��c��OH-��=10-2mol/L����֪pH=11������Kw�Ĺ�ʽ���㣻0.1mol•L-1��HA��Һ��$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=109������Kw����c��H+�������ж�����ǿ����
��2��pH֮��Ϊ13��NaOH��Һ��HA��Һ��c��OH-��=c��H+���������������ᣬ���Ũ�ȴ���������Ũ�ȣ�
��3��HA��������ʣ���ˮϡ��HA���ٽ�HA���룬��n��A-����n��H+������n��HA����С����������ӡ�������Ũ������ij̶�С����Һ�������ij̶ȣ�����c��A-����c��H+����c��HA������С���ݴ˷������
��4��HA��������ʣ��ڷ�Ӧ������HA��������������ӣ���Ӧ������HA��pH����̶�С��HCl������ȫ��Ӧ��HA��������pH��ȣ���HA��Ӧ�����ʵ����������ᣬ�������п֮��Ĺ�ϵ���㣮
��� �⣺��1��0.01mol•L-1NaOH��Һ��c��OH-��=10-2mol/L����֪pH=11����c��H+��=10-11mol/L����Kw=c��OH-����c��H+��=10-13��0.1mol•L-1��HA��Һ��$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=109����֪Kw=10-13����c��H+��=10-2mol/L��������Ũ��С�����Ũ�ȣ�����HAΪ���
�ʴ�Ϊ��10-13������
��2��pH֮��Ϊ13��NaOH��Һ��HA��Һ������������Һ��c��OH-�����ڴ�����Һ��c��H+���������������ᣬ���Ũ�ȴ���������Ũ�ȣ����Ի�Ϻ�����ʣ�࣬����Һ�����ԣ�
�ʴ�Ϊ���
��3��A����ˮϡ�ͣ�c��A-����c��H+������С������ˮҲ����������ӣ�����c��H+����С�ij̶�С����$\frac{c��{H}^{+}��}{c��{A}^{-}��}$ ������A����
B����ˮϡ�ͣ��ٽ����룬��n��A-������n��HA����С������$\frac{c��HA��}{c��{A}^{-}��}$ ��С������ȷ��
C����Һ��c��H+����c��OH-���ij˻�Ϊ�������¶Ȳ��䣬�� c��H+����c��OH-���ij˻����䣬��C����
D����ˮϡ�ͣ���Һ���������c��A-����c��HA������С��������Һ��c��A-��•c��HA����ֵ��С����D��ȷ��
E����ˮϡ�ͣ���Һ���������c��H+����С����ˮ�ĵ�������Ƴ̶ȼ�С������ˮ�ĵ���̶�����E����
�ʴ�Ϊ��BD��
��4����HA��������ʣ��ڷ�Ӧ������HA����������ӣ����Է�Ӧ������HA��C��H+������HCl����HA��pH����̶�С��HCl�����Ա�ʾHA��Һ��pH�仯����ΪB��
�ʴ�Ϊ��B��
�ڵ���ȫ��Ӧ��HA��������pH��ȣ���μӷ�Ӧ��n��HA����n��HCl���������ĵ�Խ�࣬��μӷ�Ӧ��Zn������Խ������m1��m2��
�ʴ�Ϊ������
���� ���⿼��������ʵĵ���ƽ�⼰��Ӱ�졢pH�����ϡ�͵�֪ʶ����Ŀ�Ѷ��еȣ�ע��ˮ�������Խ��Խˮ���ϡ����ǿ�ı仯������������ۺ��Խϴ�ֿ�����ѧ�������Ӧ��������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| 0.01mol•L-1����Һ | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ʾ0.001 mol•Lһ1����ζ�0.001 mol•Lһ1NaOH��Һ�ĵζ����� | |
| B�� |  ��ʾ��ʯī���۵�Ƚ��ʯ�� | |
| C�� | 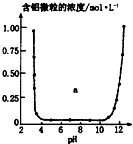 ��ʾ����Al3+��OHһ��Ӧʱ������Ũ�ȱ仯���ߣ�ͼ��a�����������Al��OH��3 | |
| D�� | 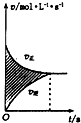 ��ʾ��ͼ�е���Ӱ��������ĺ�����[v������-v���棩��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com