
25 ℃时,水的电离达到平衡:H2O![]() H++OH- DH>0,下列叙述正确的是
H++OH- DH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
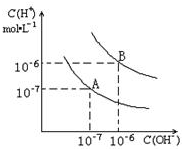
 水的电离平衡曲线如图所示.?
水的电离平衡曲线如图所示.?查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | B、向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | C、向纯水中加入少量固体碳酸钠,c(H+)减小,Kw不变,影响水的电离平衡 | D、向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:山东省期末题 题型:单选题
 H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com