


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、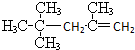 的名称为2,2,4-三甲基戊烯 的名称为2,2,4-三甲基戊烯 |
B、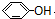 、 、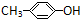 和 和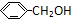 互为同系物 互为同系物 |
| C、CH≡CCH2CH3的所有碳原子在一条直线上 |
D、HCHO和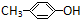 在一定条件下能发生缩聚反应生成 在一定条件下能发生缩聚反应生成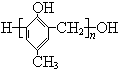 |
查看答案和解析>>
科目:高中化学 来源: 题型:
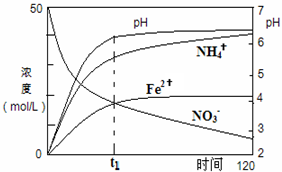 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.查看答案和解析>>
科目:高中化学 来源: 题型:
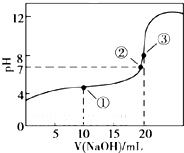 常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )
常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )| A、滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、点①所示溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、点②所示溶液中c(CH3COOH)>c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| D、点③所示溶液中c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在 |
| B、向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
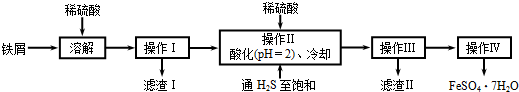
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、X、Y、M的单质分别与水反应,Y最剧烈 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、Y的氧化物水化物的酸性一定强于R的氧化物水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
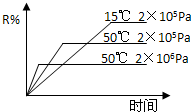 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com