
【题目】物质 R2CO3 的饱和溶液 V mL,密度为 ρ g·cm-3 , R+的物质的量浓度为 c mol·L-1 ,溶质的质量分数为 a% ,溶质的相对分子量为 M,溶质的溶解度为 s g。则下列表达式正确的是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
科目:高中化学 来源: 题型:
【题目】以下转化关系中,元素X、Y是短周期同主族元素,元素Z是过渡元素。

已知:①Z2X、Z2Y不溶于水
②浓硝酸具有强氧化性,反应中常被还原成二氧化氮气体
下列说法不正确的是
A. Z2X是Cu2S、Z2Y是Cu2O
B. 步骤①发生的反应,其离子方程式可能为Cu2S+12H++10NO3ˉ = 2Cu2++10NO2↑+SO42ˉ+6H2O
C. 步骤②发生的反应,其离子方程式为H++OHˉ=H2O、Cu2++2OHˉ=Cu(OH)2↓
D. 步骤③发生的反应,说明葡萄糖具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【广州市2017届4月综合测试(二)】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
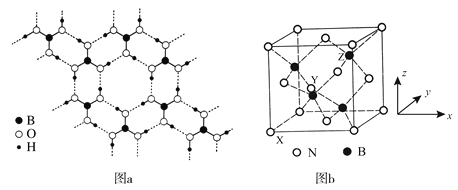
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。
① B原子的杂化方式为________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:________。
(4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。
① 与氮原子直接连接的硼原子构成的几何形状为________。硼原子和氮原子所连接的最小环为________元环。
② 晶胞有两个基本要素:
原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。
晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 代表阿伏加德罗常数的值,下列说法正确的是
A. 1 L 0.1 mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2![]()
C. 1molCl 2 完全反应,转移的电子数一定为 2N A
D. 14 g 乙烯和丙烯混合气体中的氢原子数为 2N A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】甲乙两实验小组同学对铁及其化合物的性质进行如下探究:
I.甲组同学利用如图装置探究过量铁粉与浓H2SO4反应产生的气体成分。
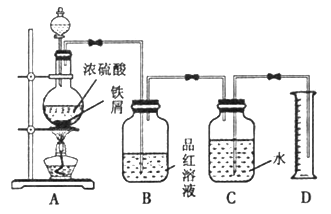
(1)组装好实验仪器后,接下来的实验操作是____________________;
(2)B中观察到品红溶液褪色,D中收集到VmL水,说明A中反应产生气体的成分
是______________________。
II.乙组同学对反应后圆底烧瓶溶液中所含金属离子进行探究。
(3)铁与浓H2SO4的反应过程中必有Fe3+生成。取适量反应后的溶液,加入少量KSCN溶液,不变红色。原因是_______________(用离子方程式表示)。
(4)取适量反应后的溶液,加人少量酸性高锰酸钾溶液,溶液褪色。该反应原理的离子方程式为 _______________________。
(5)取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去。
①分析其可能的原因是:
A.溶液中Fe3+被氧化成更髙价;
B.____________________________;
C.______________________。
②请选用下列合适的化学试剂,验证结论A是否正确。0.lmol/L FeCl3溶液、lmol/L FeCl2溶液、KSCN溶液、新制氯水、一定浓度的H2O2溶液。
操作、现象及相关结论为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【厦门第一中学2017届考前模拟】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如下实验制备卤砂并进行元素测定。
I.实验室制备卤砂:所需装置如下,装置可重复选用。

(1)装置接口连接顺序是_________→a;b←_________。
(2)C装置的作用是___________,D装置盛装的物质是_________________。
(3)写出用上述装置制备氨气的一组试剂:_________________。
Ⅱ.测定卤砂中C1元素和N元素的质量之比。
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按下图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。
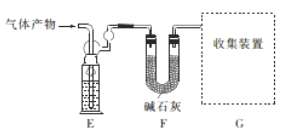
(4)E装置内的试剂为________________。
卤砂与氧化铜混合加热反应的化学方程式为________________。
(5)卤砂中Cl元素和N元素的质量之比为_________(用含b、v的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将a g卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出H2O2和稀硫酸的混合溶液与金属铜反应的离子方程式:____________________________________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,该反应的氧化剂是________;当生成19.2 g Cu 时,反应中转移的电子为________ mol。
6Cu+SO2↑,该反应的氧化剂是________;当生成19.2 g Cu 时,反应中转移的电子为________ mol。
(3)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。称取a g试样配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(发生的反应为2Cu2++4I-===2CuI↓+I2);继续滴加 KI 溶液至沉淀不再产生,反应生成的 I2 与V mL c mol·L-1Na2S2O3溶液恰好完全反应(发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6)。则试样中CuSO4·5H2O的质量分数为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com