
| A. | 石灰石与足量盐酸反应 | B. | 碳酸钠与足量盐酸反应 | ||
| C. | 碳酸钠与足量醋酸反应 | D. | 碳酸钡与足量硝酸反应 |
分析 能用离子方程式CO32-+2H+═H2O+C02↑表示的反应,必须满足可溶性的碳酸盐与强酸反应生成可溶性盐的一类反应,据此进行判断.
A.石灰石为难溶物,离子方程式中不能拆开;
B.碳酸钠与足量盐酸反应生成氯化钠、二氧化碳和水;
C.醋酸为弱酸,离子方程式中需要保留分子式,碳酸钠需要拆开;
D.碳酸钡为难溶物,离子方程式中不能拆开.
解答 解:A.石灰石为碳酸钙,碳酸钙为难溶物,离子方程式中需要保留化学式,离子方程式为:CaCO3+2H+═H2O+CO2↑+Ca2+,故A错误;
B.碳酸钠为可溶性的盐,盐酸为强酸,二者反应生成可溶性的氯化钠,其离子方程式可以用CO32-+2H+═H2O+C02↑表示,故B正确;
C.碳酸钠溶液与足量醋酸反应,醋酸为弱酸,不能拆开,碳酸钠应该拆开,离子方程式为:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O,故C错误;
D.碳酸钡难溶于水,与盐酸反应生成氯化钡和二氧化碳气体,离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式的书写方法,熟悉常见的难溶物、弱电解质、气体,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 放电时钠金属片发生氧化反应 | |
| B. | 充电时碳纳米管接直流电源的正极 | |
| C. | 放电时每消耗3molCO2,转移12 mol电子 | |
| D. | 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
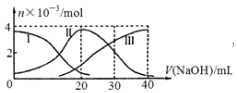 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
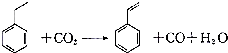 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 苯乙烯分子中含有4个碳碳双键 | B. | 苯乙烯分子式为C8H10 | ||
| C. | 乙苯有三种同分异构体 | D. | 乙苯能发生取代、加成和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
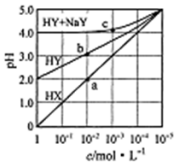 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液中滴加硫氰化钾溶液 | B. | 氯化铝中滴加石蕊指示剂 | ||
| C. | 偏铝酸钠溶液中滴加酚酞指示剂 | D. | 氯化亚铁溶液中滴加硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
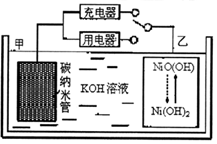 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 电池总反应为H2+2NiOOH$?_{放电}^{充电}$2Ni(OH)2 | |
| B. | 放电时,甲电极为负极,OH-移向乙电极 | |
| C. | 放电时,乙电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com