
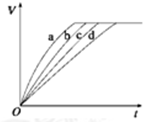
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
分析 相同时间内生成氢气的体积越大,说明反应速率越快,由图可知,反应速率a>b>c>d,根据外界条件(浓度、温度、压强、催化剂、固体表面积)对化学反应速率的影响进行分析.
解答 解:相同时间内生成氢气的体积越大,说明反应速率越快,由图可知,反应速率a>b>c>d,
A.由图可知,相同时间内,曲线d生成的氢气的体积最少,故第4组实验的反应速率最慢,故A正确;
B.第1组反应速率比第4组快,1、4组相比,温度相同,1组固体表面积更大,故第1组盐酸的浓度可能等于、小于或大于2.5mol•L-1,故B正确;
C.第2组反应速率比第4组快,2、4组相比,温度相同,2组固体表面积更大,故第2组盐酸的浓度可能等于、小于或大于2.5mol•L-1,故C正确;
D.第3组反应速率比第4组快,3、4组相比,浓度、固体表面积相同,温度越高反应速率越快,故第3组实验的反应温度高于30℃,故D错误;
故选D.
点评 本题考查影响反应速率的因素,为高频考点,把握反应速率的影响因素等为解答的关键,侧重分析与应用能力的考查,注意控制盐酸浓度、反应温度、铁的颗粒大小不同对化学反应速率的影响,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | D>B>A>C>E | B. | D>A>B>C>E | C. | A>B>C>E>D | D. | D>E>B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解池的反应属于自发过程 | |
| B. | 化学反应热效应数值与参加反应的物质多少有关 | |
| C. | 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2CO3>H2SiO3 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:K2CO3>KHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 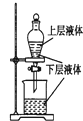 提取海带中的碘 | B. | 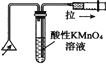 检验火柴燃烧产生的SO2 | ||
| C. | 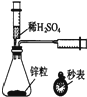 测定一定时间内生成H2的反应速率 | D. | 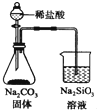 证明非金属性Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ag+、Cl- | B. | Mg2+、Al3+、OH- | C. | K+、Na+、Cl- | D. | NH4+、MnO4-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com