
 硫酸工业用SO2制取SO3的反应为:2SO2(g)+O2(g)
硫酸工业用SO2制取SO3的反应为:2SO2(g)+O2(g)| 催化剂 |
| 加热 |
| 温 度 | 200℃ | 300℃ | 400℃ |
| 平衡常数 | K1 | K2 | K3 |
| 催化剂 |
| △ |
| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 总质量 |
| 总物质的量 |


科目:高中化学 来源: 题型:
| A、淀粉、油脂、蛋白质都能水解,且水解产物各不相同 |
| B、从煤的干馏产物中可以获得焦炉气、粗氨水、煤焦油、焦炭等重要的化工原料 |
| C、石油催化裂化的主要目的是提高芳香烃的产量 |
| D、核酸是一类含磷的生物高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) |
| B、C(Na+)>C(HCO3-)>C(CO32-)>C(OH-) |
| C、C(Na+)>[C(CO32-)+C(HCO3-)+C(H2CO3)] |
| D、C(CO32-)>C(HCO3-)>C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,pH=2的HCl溶液中含有H+的数目为0.01NA |
| B、1mol Na2O2固体中含有的阴阳离子总数为4 NA |
| C、1mol碳烯(:CH2)中含有的电子数8NA |
| D、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
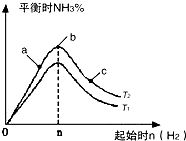 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
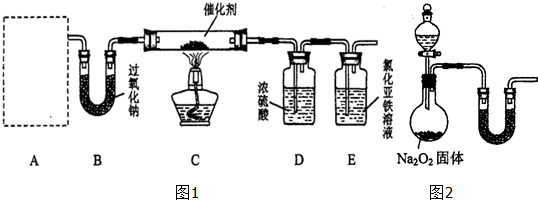
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com