
| A、该溶液的pH小于7 |
| B、c(CH3COOH)+c(CH3COO-)=0.20mol?L-1 |
| C、c(CH3COOH)<c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=0.10mol?L-1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
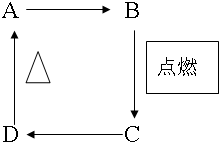 中学化学中常见化合物A、B、C、D的转化关系如图(某些反应物、产物略去).常温下B、C都是气体,又知A、C都是酸性氧化物,其中A是一种高熔点化合物,不溶于硫酸、硝酸、却溶于氢氟酸,固体C可用于人工降雨
中学化学中常见化合物A、B、C、D的转化关系如图(某些反应物、产物略去).常温下B、C都是气体,又知A、C都是酸性氧化物,其中A是一种高熔点化合物,不溶于硫酸、硝酸、却溶于氢氟酸,固体C可用于人工降雨查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、③②① |
| C、②①③ | D、②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙烷(乙烯) | 氢气 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe |
| HCl |

 的所有原子
的所有原子查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.| 7 |
| 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com