
| A、5 | B、8 | C、9 | D、10 |
| 2×8+2-10 |
| 2 |
| 2×8+2-10 |
| 2 |


科目:高中化学 来源: 题型:
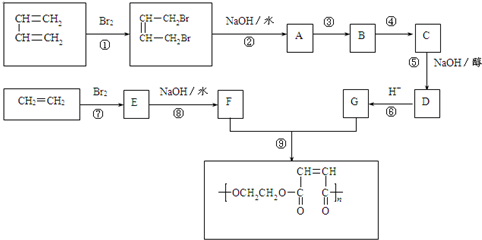
查看答案和解析>>
科目:高中化学 来源: 题型:
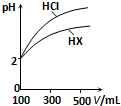 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
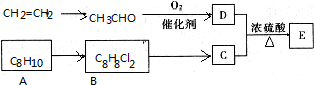
查看答案和解析>>
科目:高中化学 来源: 题型:

| (1)B2H4 |
| (2)H2O/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、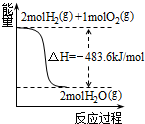 可得H2的燃烧热为483.6kJ?mol-1 |
B、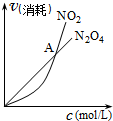 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C、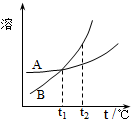 表示A、B两物质的溶解度随温度的变化情况,将t1℃时的A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A |
D、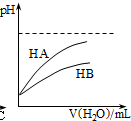 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加入水量的变化,则常温时同浓度的NaA溶液的pH小于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
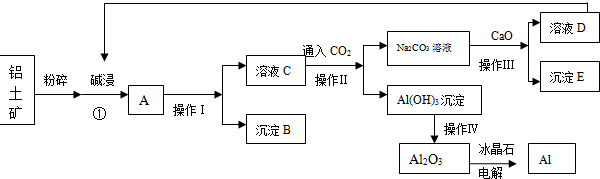
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO2(mol) | 0.05 | 0.15 | 0.6 |
| NaX(mol) | |||
| Na2CO3(mol) | |||
| NaHCO3(mol) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com