
 .
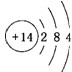
.分析 (1)硅原子核内质子数=电子数=14;
(2)陶瓷、玻璃、水泥等都是硅酸盐产品;
(3)二氧化硅与HF反应生成四氟化硅和水;
(4)二氧化硅与NaOH溶液反应具有粘合性的硅酸钠;
(5)A.SiO2是一种酸性氧化物,故A错误;
B.第①步制备粗硅的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,故B正确;
C.第②步制SiHCl2的反应中,H2是还原产物,故C错误;
D.从制备硅的主要步骤来看,有三步涉及氧化还原反应,故D错误.
解答 解:(1)硅原子的结构示意图: ,
,
故答案为: ;
;
(2)①长江三峡水泥大坝是硅酸盐,故①正确;
②石英光导纤维的成分是二氧化硅,不是硅酸盐,故②错误;
③陶瓷坩埚是硅酸盐,故③正确;
④普通玻璃是硅酸盐,故④正确;
⑤硅太阳能电池的成分是硅单质,不是硅酸盐,故⑤错误;
故答案为:D;
(3)二氧化硅与HF反应生成四氟化硅和水,其反应的方程式为:SiO2+4HF=SiF4↑+2H2O;
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)二氧化硅与NaOH溶液反应具有粘合性的硅酸钠,反应为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(5)A.SiO2是一种酸性氧化物,故A错误;
B.第①步制备粗硅的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,故B正确;
C.第②步制SiHCl2的反应中,H2是还原产物,故C错误;
D.从制备硅的主要步骤来看,有三步涉及氧化还原反应,故D错误.
故答案为:B.
点评 本题考查了硅及其化合物,涉及硅的制备与提纯,硅、二氧化硅的用途,明确相关物质的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
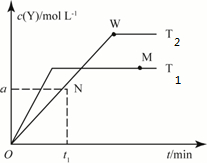 ( )
( )| A. | T2下,在0~t1时间内v(X)=$\frac{a}{{t}_{1}}$mol•L-1•min-1 | |
| B. | N点时气体的总压强大于W点时气体的总压强 | |
| C. | M点的正反应速率小于N点的逆反应速率 | |
| D. | W点时再加入一定量Y,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
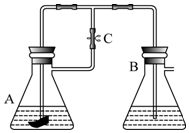 另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英、水晶、玛瑙的主要成分都是单质硅 | |
| B. | 硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 | |
| C. | 实验室存放氢氧化钠溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 | |
| D. | 二氧化硅是一种良好的半导体材料,也是制造光导纤维的一种基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3所含的分子数为NA个 | |
| C. | 足量铜与11.18mol/L浓硫酸反应可以得到SO2的分子数总数为9NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO和CO2混合气体中含有碳原子树木为0.5NA | |
| B. | 常温常压下,71g氯气与足量氢氧化钠溶液反应转移的电子数为NA | |
| C. | 92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4LCl2完全溶于水中,溶液中n(Cl-)+n(ClO-)+n(HClO)<2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | Z |
| 单质是淡黄色固体 | 与W同周期,其单质常用作半导体材料 | 原子最外层电子数是电子总数的$\frac{2}{3}$ | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 简单离子半径:Z>W | |
| D. | 工业上用Y单质还原Z的氧化物得Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com