
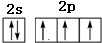
 ,C与氢元素的阳离子为铵根离子,中心原子氮的价层电子对数为
,C与氢元素的阳离子为铵根离子,中心原子氮的价层电子对数为| 5+3 |
| 2 |
 ;sp3;
;sp3; ,
, ;
;| 7+1 |
| 2 |
| 1 |
| 2 |
| 2 |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
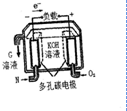
 利用如图所示装置制备氧气并进行相关实验探究.
利用如图所示装置制备氧气并进行相关实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
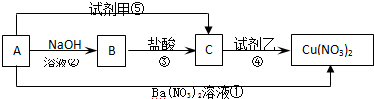
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重金属离子对人体有毒,常采用沉淀反应将之除去 |
| B、化肥中含有植物营养素,可大量使用以改善水环境 |
| C、轧钢厂排出的含盐酸的废水,可用熟石灰中和处理 |
| D、天然水中的细小悬浮颗粒,可用明矾等混凝剂净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 操作 |
| A | 配制80mL 1.0mol?L-1CuSO4溶液 | 将25g CuSO4?5H2O溶于蒸馏水配制成100mL溶液 |
| B | 除去KCl中少量KClO3 | 将混合物(加少量MnO2)置于坩埚中灼烧至固体质量不再减少 |
| C | 在溶液中将MnO4- 完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁抗腐蚀能力比纯铁强 |
| B、钢瓶在储存液氯前彻底干燥可减缓腐蚀 |
| C、水库铁闸与直流电源正极相连可减缓腐蚀 |
| D、常温下浓硝酸比浓盐酸更易使铁腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com