

分析 “向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气”可知Zn 与I2 在H2 O为催化剂下反应生成ZnI2 (D),又因H为黄色固体单质,可知H为S,再结合题设条件和框图转化可推知G为H2 S,F为HI溶液,E为AgNO3 溶液,I为Zn(NO3 )2 溶液、J为AgI沉淀、L为HNO3 溶液、K为Zn(OH)2,B和G生成F和H,则B为碘,所以A为锌,电解AgNO3 溶液时,Ag+ 在阴极获得电子产生Ag:4Ag++4e-=4Ag,OH- 在阳极失去电子产生O2:4OH--4e-=2H2 O+O2↑,据此答题.
解答 解:O为催化剂下反应生成ZnI2 (D),又因H为黄色固体单质,可知H为S,再结合题设条件和框图转化可推知G为H2 S,F为HI溶液,E为AgNO3 溶液,I为Zn(NO3 )2 溶液、J为AgI沉淀、L为HNO3 溶液、K为Zn(OH)2,B和G生成F和H,则B为碘,所以A为锌,
(1)根据上面的分析可知,B为碘,H为硫,
故答案为:碘;硫;
(2)根据上面的分析可知,黄色沉淀J 的化学式为AgI,黑色沉淀的化学式为Ag2S,
故答案为:AgI;Ag2S;
(3)B和G反应的离子方程式为I2+H2S=S↓+2H++2I-,
故答案为:I2+H2S=S↓+2H++2I-;
(4)电解AgNO3 溶液时,Ag+ 在阴极获得电子产生Ag:4Ag++4e-=4Ag,OH- 在阳极失去电子产生O2:4OH--4e-=2H2 O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;Ag++e-=4Ag.
点评 本题主要考查了常见物质的推断与性质,根据A、B在水的条件下反应的现象进行推断是解题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
| 第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
| 第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
| 第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
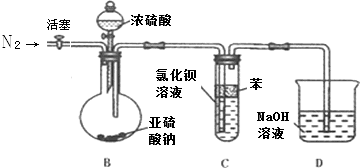
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
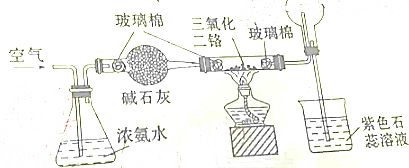
| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com