
| A. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| B. | 污水处理可采用混凝法,明矾是一种常用的混凝剂 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
分析 A.根据蛋白质变性的条件是:受热、高能射线,紫外线、强酸、强碱、重金属盐、某些有机物;
B.明矾能水解生成生成胶体,胶体具有吸附性;
C.二氧化硅常作为制备光导纤维的主要材料;
D.加碘盐中加入的是碘的化合物,不是碘单质.
解答 解:A.为了防止蛋白质变性,疫苗等生物制剂应冷冻保藏,故A错误;
B.明矾溶于水,铝离子水解生成胶体,胶体具有吸附性,使悬浮物凝聚而沉淀,故能净化水,所以明矾是一种常用的混凝剂,故B正确;
C.二氧化硅常作为制备光导纤维的主要材料,故C错误;
D.碘与淀粉变蓝是指与碘单质与淀粉变蓝,而不是碘的化合物,而食盐加碘加入的是碘的化合物,故D错误;
故选B.
点评 本题考查常见元素及其化合物的性质,明确物质的性质和用途是关键,为常考查点,题目难度不大,注意蛋白质盐析和变性的条件.


科目:高中化学 来源: 题型:选择题
| A. | 把SO2通入紫色石蕊溶液中,石蕊溶液 会变红 | |
| B. | 把SO2通入品红溶液中,品红溶液会褪色 | |
| C. | 将足量SO2通入酸性高锰酸钾溶液中,溶液褪色 | |
| D. | 把SO2通入氯化钡溶液中,溶液会出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解水实验中,加入硫酸钠可以提高电解效率 | |
| B. | 碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成 | |
| C. | 铁制品在海水中比在纯水中更易腐蚀 | |
| D. | 在双氧水中加FeCl3溶液可使产生O2速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | 将标准状况下的2.24LCO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| C. | 0.1mol•L-1的醋酸pH=a,0.01mol•L-1的醋酸pH=b,则a+1>b | |
| D. | 常温时①pH=12的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH变小 | B. | 阴极逸出气体 | ||
| C. | 阳极附近溶液呈蓝色 | D. | 阴极附远溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
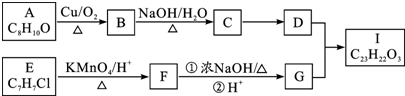
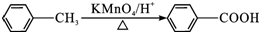
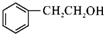 ,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为
,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为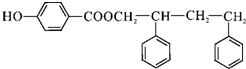 .
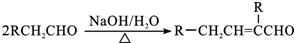
. ,F→G①的化学方程式为
,F→G①的化学方程式为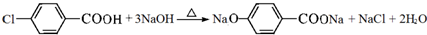 .
.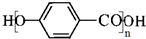 .
.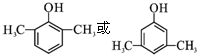 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
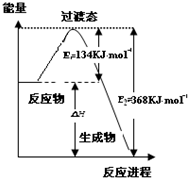 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com