
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol?L-1 HCl溶液 | 沉淀溶解 |
| Ⅱ | 4mL 2mol?L-1 NH4Cl溶液 | 沉淀溶解 |


科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |

| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化(Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O | ||||
B、高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)
| ||||
| C、工业制取漂粉精:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||||
| D、实验室制取氨气:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,醋酸钠与醋酸的混合溶液pH=7,C(Na+)>c(CH3COO-) |
| B、0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、将pH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
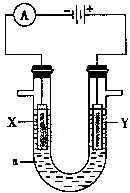 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com