
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。![]() 是一种三角锥型分子,键角
是一种三角锥型分子,键角![]() ,沸点
,沸点![]() ;可在铜的催化作用下由
;可在铜的催化作用下由![]() 和过量
和过量![]() 反应得到:
反应得到: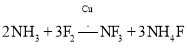
![]() 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 离子键
离子键![]() 共价键
共价键![]() 配位键
配位键![]() 金属键
金属键
![]() 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
![]() 理论上HF、
理论上HF、![]() 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、![]() 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
![]() 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据![]() 单位:
单位:![]()
![]() ,回答下面各题:
,回答下面各题:
元素代号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。
【答案】abcd ![]()
![]() 能形成氢键,
能形成氢键,![]() 只有范德华力
只有范德华力 ![]() 6 R U p 平面三角形
6 R U p 平面三角形 ![]()
【解析】
![]() 中含有离子键、共价键和配位键,Cu含有金属键;
中含有离子键、共价键和配位键,Cu含有金属键;
![]() 与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理书写其基态原子核外电子排布式;
与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理书写其基态原子核外电子排布式;
![]() 分子间氢键的存在导致分子晶体的熔沸点升高;
分子间氢键的存在导致分子晶体的熔沸点升高;
![]() 根据题意可写出反应的化学方程式:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,
根据题意可写出反应的化学方程式:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,![]() 中心离子为
中心离子为![]() ,配位数为6;
,配位数为6;
![]() 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现
由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现![]() 价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现
价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现![]() 价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现
价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现![]() 价,最外层电子数为3;
价,最外层电子数为3;
![]() 根据原子最后填入的电子名称确定该元素所属区域;根据价层电子对互斥理论确定微粒构型、原子杂化方式。
根据原子最后填入的电子名称确定该元素所属区域;根据价层电子对互斥理论确定微粒构型、原子杂化方式。
![]() 中含有离子键、共价键和配位键,Cu属于金属单质含有金属键,NH3、NF3、F2中含共价键;故答案为:abcd;
中含有离子键、共价键和配位键,Cu属于金属单质含有金属键,NH3、NF3、F2中含共价键;故答案为:abcd;
![]() 与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理知,其基态原子核外电子排布式为
与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理知,其基态原子核外电子排布式为![]() 或
或![]() ,则其价电子排布式为
,则其价电子排布式为![]() ;故答案为:
;故答案为:![]() ;
;
![]() 分子间能形成氢键,
分子间能形成氢键,![]() 只有范德华力,分子间氢键的存在导致分子晶体的熔沸点升高,所以
只有范德华力,分子间氢键的存在导致分子晶体的熔沸点升高,所以![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多,故答案为:
低得多,故答案为:![]() 能形成氢键,
能形成氢键,![]() 只有范德华力;
只有范德华力;
![]() 由题意可知该反应的化学方程式应为:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,该微溶物为:
由题意可知该反应的化学方程式应为:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,该微溶物为:![]() ,中心离子为Al或
,中心离子为Al或![]() ,配位数为6,故答案为:
,配位数为6,故答案为:![]() ;6;
;6;
![]() 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现
由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现![]() 价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现
价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现![]() 价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现
价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现![]() 价,最外层电子数为3,R和U的第一电离能较小,第二电离能剧增,故表现
价,最外层电子数为3,R和U的第一电离能较小,第二电离能剧增,故表现![]() 价,最外层电子数为1,二者位于同一族,故答案为:R;U;
价,最外层电子数为1,二者位于同一族,故答案为:R;U;
![]() 的第一、第二、第三电离能较小,第四电离能剧增,表现
的第一、第二、第三电离能较小,第四电离能剧增,表现![]() 价,最外层电子数为3,可能为第IIIA族元素,其最后填入的电子是p电子,最可能是p区元素;若T为第二周期元素,则T是B元素,F是第三周期元素中原子半径最小的元素,则F是Cl元素,T、F二者形成的化合物是
价,最外层电子数为3,可能为第IIIA族元素,其最后填入的电子是p电子,最可能是p区元素;若T为第二周期元素,则T是B元素,F是第三周期元素中原子半径最小的元素,则F是Cl元素,T、F二者形成的化合物是![]() ,
,![]() 中B原子价层电子对数
中B原子价层电子对数![]() 且不含孤电子对,所以
且不含孤电子对,所以![]() 为平面正三角形,B原子采用
为平面正三角形,B原子采用![]() 杂化,故答案为:p;平面三角形;
杂化,故答案为:p;平面三角形;![]() 。
。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】新型冠状病毒对紫外线和热敏感,有些方法还是可以有效灭活病毒的,下列说法错误的是
A.疫苗一般应冷藏存放
B.75%的酒精杀菌消毒的原理是使蛋白质变性
C.含氯消毒剂(如84消毒液)使用过程中有化学反应发生
D.过氧乙酸(CH3COOOH)中氧原子的杂化方式为sp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.键角:BF3>CH4>H2O>NH3
B.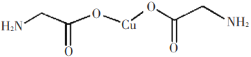 中σ键和π键比例为7:1
中σ键和π键比例为7:1
C.已知二茂铁(Fe(C5H5)2)熔点是173![]() (在100
(在100![]() 时开始升华),沸点是249
时开始升华),沸点是249![]() ,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,
,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,![]() 与Fe2+之间是以离子键相结合
与Fe2+之间是以离子键相结合
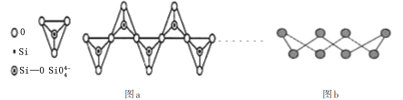
D.在硅酸盐中,![]() 四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-= BaSO4↓
B. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C. SiO2和氢氧化钠溶液的反应:SiO2+2OH-=SiO32-+H2O
D. 用FeCl3溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 缓慢通入水中至饱和,然后向所得饱和氯水中滴加
缓慢通入水中至饱和,然后向所得饱和氯水中滴加![]() 的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
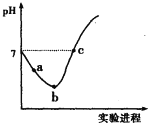
A.实验进程中可用pH试纸测定溶液的pH
B.c点所示溶液中:![]()
C.向a点所示溶液中通入![]() ,溶液的酸性和漂白性均增强
,溶液的酸性和漂白性均增强
D.由a点到b点的过程中,溶液中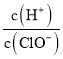 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
![]() 尿素
尿素![]() 与氰酸铵
与氰酸铵![]() 互为 ______ ;氰酸铵属于 ______ 化合物
互为 ______ ;氰酸铵属于 ______ 化合物![]() 选填:“离子”或“共价”
选填:“离子”或“共价”![]() 。
。
![]() 液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量
液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量![]() 选填:“吸收”或“释放”
选填:“吸收”或“释放”![]() 液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
![]() 氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和
氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是 ______ ![]() 不定项选择
不定项选择![]() 。
。
![]() 反应速率
反应速率![]()
![]()
![]()
![]() 容器内压强不再随时间而发生变化
容器内压强不再随时间而发生变化
![]() 容器内
容器内![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
![]() 容器内
容器内![]() :
:![]() :
:![]() :
:![]() :4:5:6
:4:5:6
②某次实验中测得容器内NO及![]() 的物质的量随时间变化如图2所示,图中
的物质的量随时间变化如图2所示,图中![]() 正
正![]() 与
与![]() 逆
逆![]() 相等的点为 ______
相等的点为 ______ ![]() 选填字母
选填字母![]() 。
。

![]() 已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 |
|
|
|
能量变化 | 436 |
| 946 |
则合成氨反应:![]()
![]() ______
______ ![]()
![]() 工业上用氨水吸收硫酸工业尾气中的
工业上用氨水吸收硫酸工业尾气中的![]() ,既可消除污染又可获得
,既可消除污染又可获得![]() 等产品.若用1000kg 含
等产品.若用1000kg 含![]() 质量分数为
质量分数为![]() 的氨水吸收
的氨水吸收![]() 且全部转化为
且全部转化为![]() ,不考虑其它成本,则可获得的利润为 ______ 元
,不考虑其它成本,则可获得的利润为 ______ 元![]() 参照下面的价格表
参照下面的价格表![]() 。
。
| 无水 | |
价格 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com