
2Zn(OH)2•ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2•ZnCO3的工艺流程如下:

请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:实验题
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,(如下图所示)得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入碎瓷片,目的是 。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是: 。
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,能够生成1mol乙酸乙酯? ,原因是 。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
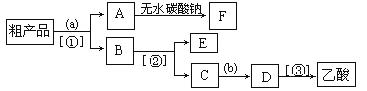
试剂a是_ __;试剂b是 ;分离方法①是______________,分离方法②是 _______,分离方法③是_______________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是 。
(6)写出C→D反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
有A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B的最简式相同
D.A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
向10 mL 0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是:( )
A.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)<c(Al3+)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法中不正确的是( )
A.光导纤维遇强碱会“断路”
B.福岛核电站泄露的放射性物质l31I和127I互为同位素,化学性质几乎相同
C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因
D.氢氧化铁溶胶、甘油与乙醇的混合液、含PM2.5的大气均具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:选择题
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向0.1molFeI2溶液中滴加少量 氯水,反应中有0.3NA电子转移
氯水,反应中有0.3NA电子转移
B.向溴水中加入足量氯化亚铁能使溶液变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:填空题
化学平衡原理是中学化学学习的重要内容,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气(主要成分CO、H2)制备甲醇。
(1)己知:CO、H2、CH3OH、的燃烧热(△H)分别为-283.0kJ/mol、-241.8kJ/mol、-192.2 kJ/mol,请写出合成气制备甲醇的热化学方程式 。
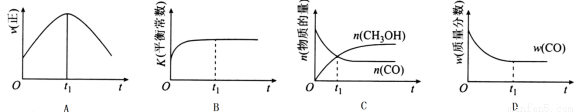
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
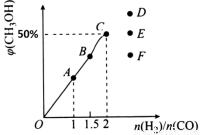
(3)在T1℃时,在体积为5 L的恒容容器中充入3 mol的合成气,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。H2和CO按2:1投入时经过5 min达到平衡,则5 min内用H2表示的反应速率为v(H2)=_______。温度不变,当 时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
(4)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:________________________。
(5)水的自偶电离可表示为H2O+H2O H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
查看答案和解析>>
科目:高中化学 来源:2016届福建厦门外国语学校高三5月月考理综化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论不一致的是
选项 | 实验操作 | 实验目的或结论 |
A |
| 通过观察液面差判断该装置的气密性 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量 | 除去MgCl2溶液中少量FeCl3 |
C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下 Ksp(BaCO3)<Ksp(BaSO4) |
D | C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得的气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:选择题
某温度下,在容积不变的密闭容器中存在下列可逆反应:A(g)+3B(g) 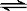 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
A.平衡不移动
B.平衡时C的物质的量增大
C.平衡向逆反应方向移动
D.平衡时混合气体的平均摩尔质量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com